题目内容
17. 二氧化碳是造成温室效应的主要气体,二氧化碳的回收再利用是减缓温室效应的有效途径之一.
二氧化碳是造成温室效应的主要气体,二氧化碳的回收再利用是减缓温室效应的有效途径之一.(1)二氧化碳重整可用于制取甲烷.已知:
CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247kJ•mol-1
CH4(g)+H2O(g)?CO(g)+3H2(g)△H2=+205kJ•mol-1
则反应CO2(g)+4H2(g)?CH4(g)+2H2(g)的△H3-163kJ/mol.
(2)一定压强下,在某恒容密闭容器中,充入H2和CO2发生反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),其起始投料比、温度与CO2的转化率的关系如图所示.
①降低温度,平衡向正反应方向移动.
②在700K、起始投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=1.5时,H2的转化率为40%.若达到平衡后H2的浓度为amol•L-1,则达到平衡时CH2CH2OH的浓度为$\frac{a}{9}$mol/L.
(3)CO2和H2在一定条件下可合成二甲醚:2CO2(g)+6H2(g)?CH3OCH3(g)+2H2O(g)△H.在一定压强下,将2.5molH2与amolCO2置于容积为1L的密闭容器中,发生上述反应,达到平衡状态时,测得反应的实验数据如下表:
| 温度/K CO2转化率/% a/mol | 500 | 600 | 700 | 800 |
| 1.67 | x | 33 | ||
| 1.25 | 60 | 43 | y | |
| 0.83 | z | 32 | w |
A.x=y B.x>y C.x<y D.无法判断
②下列关于该反应的叙述正确的是ABC.
A.该反应的△H<0,△S<0 B.该反应的平衡常数随温度升高而减小
C.转化率分别为z、w时,达到平衡的时间前者长 D.转化率分别为y、w时,平衡常数不同.
分析 (1)已知:①.CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247kJ•mol-1
②.CH4(g)+H2O(g)?CO(g)+3H2(g)△H2=+205kJ•mol-1
根据盖斯定律,①-②×2可得:CO2(g)+4H2(g)?CH4(g)+2H2O(g),则△H3=△H1-2△H2;
(2)①由图可知,$\frac{n({H}_{2})}{n(C{O}_{2})}$一定时,温度越高,平衡时二氧化碳的转化率越小,说明升高温度平衡向逆反应方向移动,则正反应为放热反应;
②由图可知,在700K,起始投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=1.5时,二氧化碳转化率为20%,令CO2、H2的起始物质的量分别为1mol、1.5mol,转化的二氧化碳为0.2mol,根据方程式可知转化的氢气为0.6mol,进而计算H2 的转化率,再根据平衡时氢气浓度计算氢气的起始浓度,进而计算氢气浓度变化量△c(H2),由方程式可知△c(CH3CH2OH)=$\frac{1}{6}$△c(H2);
(3)①CO2起始物质的量为1.25mol时,温度越高,CO2的转化率越小,故w<32,x>33,由于CO2(g)、H2(g)按物质的量1:3反应,当二者按物质的量1:3混合时,即a=0.83,二者转化率相等,则800K时CO2、H2的转化率均为w%,CO2(g)的起始物质的量越大,其转化率越小,则y<w;
②A.CO2起始物质的量为1.25mol时,温度越高,CO2的转化率越小,说明升高温度平衡向逆反应方向移动,正反应为放热反应,正反应生成气体的物质的量减小,混乱度减小;
B.升高温度平衡向逆反应方向移动,平衡常数随温度升高而减小;
C.温度越高,反应速率越快;
D.平衡常数只受温度影响.
解答 解:(1)已知:①.CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247kJ•mol-1
②.CH4(g)+H2O(g)?CO(g)+3H2(g)△H2=+205kJ•mol-1
根据盖斯定律,①-②×2可得:CO2(g)+4H2(g)?CH4(g)+2H2O(g),则△H3=△H1-2△H2=-163kJ/mol,
故答案为:-163kJ/mol;
(2)①由图可知,$\frac{n({H}_{2})}{n(C{O}_{2})}$一定时,温度越高,平衡时二氧化碳的转化率越小,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,降低温度,平衡向放热反应方向移动,即向正反应方向移动,
故答案为:正反应;
②由图可知,在700K,起始投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=1.5时,二氧化碳转化率为20%,令CO2、H2的起始物质的量分别为1mol、1.5mol,转化的二氧化碳为mol×20%=0.2mol,根据方程式可知转化的氢气为0.2amol×3=0.6mol,H2 的转化率为$\frac{0.6mol}{1.5mol}$×100%=40%,氢气的平衡浓度为amol/L,则氢气的起始浓度为amol/L÷(1-40%)=$\frac{5a}{3}$mol/L,则△c(H2)=$\frac{5a}{3}$mol/L-amol/L=$\frac{2a}{3}$mol/L,由方程式可知△c(CH3CH2OH)=$\frac{1}{6}$△c(H2)=$\frac{1}{6}$×$\frac{2a}{3}$mol/L=$\frac{a}{9}$mol/L,
故答案为:40%;$\frac{a}{9}$mol/L;
(3)①CO2起始物质的量为1.25mol时,温度越高,CO2的转化率越小,故w<32,x>33,由于CO2(g)、H2(g)按物质的量1:3反应,当二者按物质的量1:3混合时,即a=0.83,二者转化率相等,则800K时CO2、H2的转化率均为w%,CO2(g)的起始物质的量越大,其转化率越小,则y<w,由上述分析可知x>y,
故答案为:B;
②A.CO2起始物质的量为1.25mol时,温度越高,CO2的转化率越小,说明升高温度平衡向逆反应方向移动,正反应为放热反应,即△H<0,正反应生成气体的物质的量减小,混乱度减小,则△S<0,故A正确;
B.正反应为放热反应,升高温度平衡向逆反应方向移动,平衡常数随温度升高而减小,故B正确;
C.温度越高,反应速率越快,转化率分别为z、w时,达到平衡的时间前者长,则C正确;
D.由于温度相同,则平衡常数相同,故D错误,
故选:ABC.
点评 本题考查化学平衡计算、化学平衡影响因素、反应热计算等,较好的考查学生分析能力、知识迁移运用能力.(3)中转化率比较为易错点、难度,貌似无法比较,关键是根据二者转化率相等时的特殊性分析解答.

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案| A. | Na2SO4、KNO3、Na2CO3、NH4Cl | B. | H2SO4、BaCl2、Na2SO4、NaOH | ||
| C. | MgCl2、AgNO3、KNO3、HCl | D. | NH4HCO3、NaOH、NaCl、HCl |
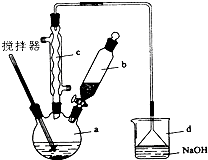 实验室制备苯乙酮的化学方程式为:
实验室制备苯乙酮的化学方程式为: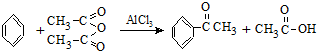
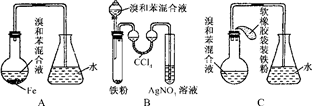
 .
.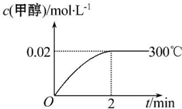 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇的反应为CO(g)+2H2(g)═CH3OH(g)△H<0.
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇的反应为CO(g)+2H2(g)═CH3OH(g)△H<0.