题目内容
【题目】已知:某原电池的总反应为:2Fe3++Cu═2Fe2++Cu2+ . 则: ①该原电池的正极材料可以选用(填材料名称): , 该电极的电极反应式是: ,
②若负极质量减少1.28克,那么电路中转移的电子数为: .
【答案】不如Cu活泼的金属或石墨电极;2Fe3++2e﹣=2Fe2+;0.04NA
【解析】解:①正极材料是不如Cu活泼的金属或石墨电极,Fe3+在正极上得电子发生还原反应,电极反应式为:2Fe3++2e﹣=2Fe2+; 所以答案是:不如Cu活泼的金属或石墨电极;2Fe3++2e﹣=2Fe2+;
② Cu﹣2e﹣=Cu2+;
64g 2mol
1.28g n
n= ![]() =0.04mol,转移电子个数为0.04NA ,
=0.04mol,转移电子个数为0.04NA ,
所以答案是:0.04NA .

练习册系列答案
相关题目
【题目】从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O.
(1)为了加快反应速率,不可以采取的措施有(填序号,下同). A.使用催化剂 B.提高氧气的浓度
C.提高反应的温度 D.降低反应的温度
(2)已知该反应为放热反应,如图能正确表示该反应中能量变化的是 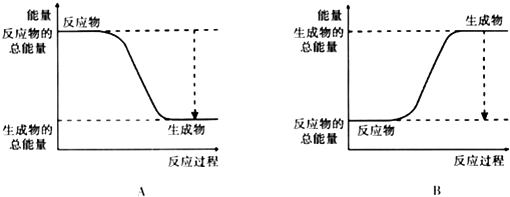
(3)从断键和成键的角度分析上述反应中能量的变化.已知化学键的键能如表:
化学键 | H﹣H | O=O | H﹣O |
键能kJmol﹣1 | 436 | 496 | 463 |
由此计算2mol H2在氧气中燃烧生成气态水放出的热量 .