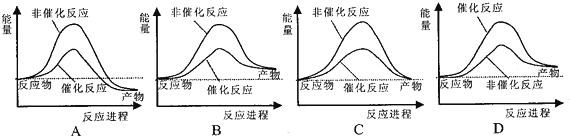
题目内容
8. 化学与社会经济建设、生态文明建设、人类健康保障、环境保护等密切相关.
化学与社会经济建设、生态文明建设、人类健康保障、环境保护等密切相关.(1)材料是经济和生态文明建设的重要物质基础.
①生产硅酸盐水泥和普通玻璃都需用到的共同原料是CaCO3(填化学式).
②橡胶可以制造汽车轮胎.橡胶属于C(填字母).
A.金属材料B.无机非金属材料C.有机高分子材料
③下列对金属制品采取的防护方法不正确的是B(填字母).
A.在电线的外面包上一层塑料层B.在海轮的铁制外壳上焊上铜块
C.在自行车钢圈上镀上一层金属铬
(2)保证食品安全、保持营养均衡,是保障人体健康的基础.
①缺乏某种微量元素将导致甲状腺肿大,且造成智力损害,该微量元素是B(填字母).
A.铁B.碘C.钙
②维生素C能促进人体生长发育.下列富含维生素C的是C(填字母).
A.鸡蛋B.牛肉C.辣椒
③人体内蛋白质在蛋白酶作用下,水解为氨基酸,在蛋清溶液中加入饱和硫酸铵溶液有沉淀析出的过程称为盐析.
④过敏是使用青霉素的主要不良反应,在用药前使用者一定要进行皮试.
(3)我国新修订的《环境保护法》已于2015年1月1日起施行,体现了加强生态文明建设的新要求.
①“APEC蓝”为2014年科技热词之首,较多地排放下列气体不利于蓝天出现的是a.
A.NO2B.N2C.CO2
②含有下列离子的废水不需要处理就可排放的是c.
A.Cr2O72-B.Pb2+C.Ca2+
③治理被酸雨侵蚀的酸性土壤,可加入适量的b.
A.CB.Ca(OH)2C.SiO2
(4)保持营养平衡、科学使用食品添加剂并合理使用药物,有助于健康和提高人体自身免疫力.
①如图为某品牌鸡精标签的一部分,其中能水解生成氨基酸的配料是鸡肉粉,属于着色剂的是姜黄,属于防腐剂的是山梨酸.
②在一支盛有2mL2%淀粉溶液的试管中滴入2滴碘水.溶液呈蓝色,再滴入维生素C的水溶液,溶液颜色变化是由蓝色变无色,该实验说明维生素C具有还原性(选填:“酸”、“氧化”或“还原”).
分析 (1)①水泥的原料是粘土和石灰石,玻璃的原料是纯碱、石灰石和石英;
②橡胶是高分子化合物;
③A.在电线的外面包上一层塑料层,能够隔绝空气;
B.在海轮的铁制外壳上焊上铜块,形成原电池,铁做负极;
C.在自行车钢圈上镀上一层金属铬,可以隔绝空气;
(2)①碘元素被称为智力元素;
②蔬菜中含有大量维生素;
③蛋白质水解生成氨基酸,蛋白质能发生盐析;
④部分抗生素会产生不良反应要做皮试;
(3)①二氧化氮有毒,容易造成光化学烟雾;
②含有重金属离子的水有毒,不能直接排放;
③碱能够中和酸中的氢离子;
(4)①蛋白质水解生成氨基酸;柠檬黄、胭脂红、胡萝卜素等是常用的着色剂;苯甲酸钠、山梨酸钾是常用的防腐剂;
②碘水与维生素C反应,溶液颜色有蓝色变为无色,碘被还原为碘离子,发生还原反应,则维生素C具有还原性;
解答 解:(1)①水泥的原料是粘土和石灰石,玻璃的原料是纯碱、石灰石和石英,二者都用到石灰石;
故答案为:CaCO3;
②橡胶是高分子化合物,属于有机高分子材料;
故选:c;
③A.在电线的外面包上一层塑料层,能够隔绝空气减慢金属的腐蚀,故正确;
B.在海轮的铁制外壳上焊上铜块,形成原电池,铁做负极,加快反应腐蚀的速率,故B错误;
C.在自行车钢圈上镀上一层金属铬,可以隔绝空气,减慢金属的腐蚀,故C正确;
故选:B;
(2)①缺乏某种微量元素将导致甲状腺肿大,且造成智力损害;
故选:B;
②蔬菜中富含维生素C,所以富含维生素C的是辣椒;
故答案为:C;
③蛋白质在一定条件下水解生成氨基酸,在蛋白质溶液中加入饱和硫酸铵溶液能发生盐析,即有白色沉淀析出;
故答案为:氨基酸;盐析;
④部分抗生素会产生不良反应要做皮试,所以使用青霉素前使用者一定要进行皮肤敏感试验;
故答案为:皮肤敏感试验;
(3)①二氧化氮有毒,容易造成光化学烟雾;二氧化碳、氮气不是大气污染物;
故选:a;
②Cr2O72-和Pb2+都含有重金属盐离子,能够造成污染,不能直接排放,钙离子属于轻金属离子,不会造成污染;
故选:c;
③碱能够中和酸中的氢离子,所以治理酸雨可以加入熟石灰;
故选:b;
(4)①根据鸡肉粉中含有蛋白质,蛋白质水解生成氨基酸,姜黄是着色剂;山梨酸是防腐剂;
故答案为:鸡肉粉;姜黄;山梨酸;
②当溶液由蓝色变无色,说明碘与维生素C反应,碘是氧化剂,维生素是还原剂,具有还原性;
故答案为:由蓝色变无色;还原;
点评 本题为综合题,考查了硅酸盐的制备、常见生活中的环境污染与治理、食品的安全与卫生,熟悉相关知识是解题关键,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | 标准状况下,11.2 L三氧化硫所含有的原子数目为2NA | |
| B. | 分解H2O2制O2,每生成1mol O2转移2NA个电子 | |
| C. | 62 g Na2O溶于水后所得溶液中含有O2-数为NA | |
| D. | 36.5 g HCl中含有Cl-数为NA |
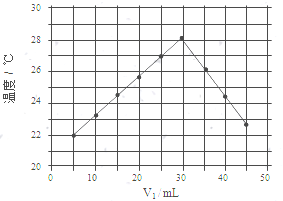
 向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )| A. | OA段所发生反应的离子方程式:H++OH-═H2O;CO32-+H+═HCO3- | |
| B. | NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1 | |
| C. | 产生的CO2体积(标准状况下)为0.056L | |
| D. | 原NaOH溶液的物质的量浓度为0.5mol•L-1 |
| A. | 用CO2合成可降解塑料,实现碳的循环利用 | |
| B. | 提倡使用太阳能、潮汐能、风能等清洁能源,减少化石燃料的使用 | |
| C. | 提高煤炭和石油的产量,以满足工业生产的快速发展 | |
| D. | 实现资源的“3R”利用,即减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、提高资源的循环利用(Recycle) |
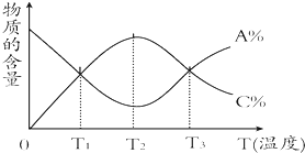
| A. | 该反应在T1、T3温度时达到化学平衡 | |
| B. | 该反应在T2温度时未达到化学平衡 | |
| C. | 升高温度,平衡会向正反应方向移动 | |
| D. | 该反应的正反应是放热反应 |
 ;.
;. 水不仅是包括人类在内所有生命生存的重要资源,也是化学反应中的重要物质:
水不仅是包括人类在内所有生命生存的重要资源,也是化学反应中的重要物质: