题目内容
(1)如图所示装置,回答下列问题
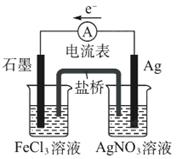
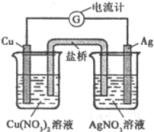
盐桥中阴离子移向 溶液,正极电极反应式为 ,该装置中发生的总反应的离子方程式为 。
(2)氨气若在纯氧中燃烧,则发生反应为4NH3+3O2点燃 2N2+6H2O,科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是______(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为 。

盐桥中阴离子移向 溶液,正极电极反应式为 ,该装置中发生的总反应的离子方程式为 。
(2)氨气若在纯氧中燃烧,则发生反应为4NH3+3O2点燃 2N2+6H2O,科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是______(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为 。
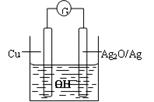
(1)AgNO3 Fe3++e-=Fe2+ Fe3++Ag==Fe2++Ag+(2)负极 2NH3 + 6OH--6e- =N2 +6H2O
(1)原电池中阴离子向负极移动,根据电子的流向可知,银电极是负极,石墨是正极,所以盐桥中的阴离子向硝酸银溶液中移动;正极得到电子,因此是溶液中的铁离子得到电子,方程式是Fe3++e-=Fe2+;负极是银失去电子,所以总的方程式是Fe3++Ag==Fe2++Ag+。
(2)原电池中负极失去电子,正极得到电子。所以根据反应的方程式可知,氧气在正极通入,氨气在负极通入。由于电解质是碱性溶液,所以负极反应式是2NH3 + 6OH--6e- =N2 +6H2O。
(2)原电池中负极失去电子,正极得到电子。所以根据反应的方程式可知,氧气在正极通入,氨气在负极通入。由于电解质是碱性溶液,所以负极反应式是2NH3 + 6OH--6e- =N2 +6H2O。

练习册系列答案
相关题目
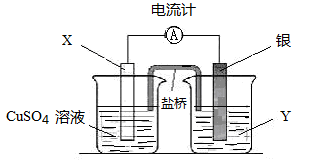
一个原电池的总反应的离子方程式是Zn+Cu2+=Zn2++Cu,该反应的原电池的正确组成是 ( )
| | A | B | C | D |
| 正极 | Zn | Cu | Zn | Fe |
| 负极 | Cu | Zn | Ag | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | CuSO4 | CuCl2 |