题目内容
(11分)依据氧化还原反应:2Ag+ (aq) + Cu(s) ="=" Cu2+ (aq) + 2Ag (s)设计的原电池如图所示。

请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 ;
(2)银电极为电池的 极;银电极上发生的电极反应式 。
(3)外电路中的电子是从 电极流向 电极(填电极的材料)。
(4)利用反应Zn + 2 FeCl3 = ZnCl2 + 2 FeCl2,设计一个原电池,在下面框图内画出有关的实验装置图:

正极的电极反应式为 。

请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 ;
(2)银电极为电池的 极;银电极上发生的电极反应式 。
(3)外电路中的电子是从 电极流向 电极(填电极的材料)。
(4)利用反应Zn + 2 FeCl3 = ZnCl2 + 2 FeCl2,设计一个原电池,在下面框图内画出有关的实验装置图:

正极的电极反应式为 。
(1)铜(1分);AgNO3溶液(1分)(2)正(1分);Ag+ + e-=Ag(2分)
(3)铜(1分);银(1分)(4)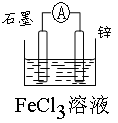 (2分);Fe3++ e-=Fe2+(2分)。
(2分);Fe3++ e-=Fe2+(2分)。
(3)铜(1分);银(1分)(4)
 (2分);Fe3++ e-=Fe2+(2分)。
(2分);Fe3++ e-=Fe2+(2分)。(1)根据总的反应式可知,铜失去电子,银离子得到电子,所以铜是负极。X电极插在硫酸铜溶液中,所以X电极是铜,因此电解质溶液Y是硝酸银。
(2)银电极为电池的正极,发生的电极反应式是Ag+ + e-=Ag。
(3)由于在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。所以外电路中的电子是从铜电极流向银电极。
(4)根据反应Zn + 2 FeCl3 = ZnCl2 + 2 FeCl2可知,锌是还原剂,失去电子,氯化铁是氧化剂得到电子。所以在原电池中锌是负极,正极材料可以是石墨或金属性弱于锌的金属等,而电解质溶液是氯化铁,所以装置图为 。其中正极的电极反应式为Fe3++ e-=Fe2+。
。其中正极的电极反应式为Fe3++ e-=Fe2+。
(2)银电极为电池的正极,发生的电极反应式是Ag+ + e-=Ag。
(3)由于在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。所以外电路中的电子是从铜电极流向银电极。
(4)根据反应Zn + 2 FeCl3 = ZnCl2 + 2 FeCl2可知,锌是还原剂,失去电子,氯化铁是氧化剂得到电子。所以在原电池中锌是负极,正极材料可以是石墨或金属性弱于锌的金属等,而电解质溶液是氯化铁,所以装置图为
 。其中正极的电极反应式为Fe3++ e-=Fe2+。
。其中正极的电极反应式为Fe3++ e-=Fe2+。
练习册系列答案
相关题目
 H2↑
H2↑
