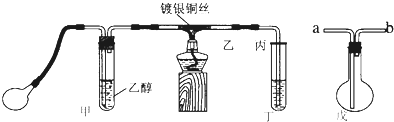
题目内容
1.已知稀的强酸溶液和稀的强碱溶液发生中和反应生成1mol H2O时,放出的热量为57.3kJ/mol,按此定义,请填空:(1)用4gNaOH配成稀溶液跟足量的稀盐酸反应,放出的热量为QkJ,则Q=0.573kJ.若将4gNaOH固体直接放入足量稀盐酸中,则放出的热量大于QkJ(填“大于”“小于”或“等于”),你的合理解释是NaOH固体溶于水要放热.
(2)用0.5molBa(OH)2配成稀溶液跟足量的稀硝酸反应放出的热量是11.46kJ.
(3)用1 mol/L的氨水溶液1L与2.00L 1.00mol/L的稀HNO3反应,放出的热量小于57.3kJ(选填“大于”“小于”或“等于”),你的合理解释是氨水是弱电解质,电离时会吸收热量,.
分析 (1)根据稀的强酸溶液和稀的强碱溶液发生中和反应生成1molH2O时,放出的热量为57.3kJ/mol,可知生成1molH2O放出热量为57.3kJ,然后根据水的物质的量与热量成正比求出热量;NaOH固体溶于水要放热;
(2)0.1mol Ba(OH)2与足量的稀硝酸反应生成0.2mol水,根据稀的强酸溶液和稀的强碱溶液发生中和反应生成1molH2O时,放出的热量为57.3kJ/mol,可知生成1molH2O放出热量为57.3kJ,然后根据水的物质的量与热量成正比求出热量;
(3)一水合氨是弱电解质,电离时会吸收热量.
解答 解:(1)稀的强酸溶液和稀的强碱溶液发生中和反应生成1molH2O时,放出的热量为57.3kJ/mol,可知生成1molH2O放出热量为57.3kJ,用4g(即0.01mol)NaOH即配成稀溶液跟足量的稀盐酸反应,会生成0.01mol水,所以此时放出的热量是0.01×57.3kJ=0.573kJ;NaOH固体溶于水要放热,若将4gNaOH固体直接放入足量稀盐酸中,则放出的热量大于QkJ;
故答案为:0.573;大于;NaOH固体溶于水要放热;
(2)根据稀的强酸溶液和稀的强碱溶液发生中和反应生成1molH2O时,放出的热量为57.3kJ/mol,可知生成1molH2O放出热量为57.3kJ,而0.1mol Ba(OH)2配成稀溶液与足量稀硝酸反应可得0.2molH2O,所以放出的热量为57.3kJ×0.2=11.46kJ,
故答案为:11.46;
(3)用1 mol/L的氨水溶液1L与2.00L 1.00mol/L的稀HNO3反应,生成1molH2O,但一水合氨是弱电解质,电离时会吸收热量,所以放出的热量小于57.3kJ;
故答案为:小于;一水合氨是弱电解质,电离时会吸收热量.
点评 本题主要考查中和热的计算及对中和热的理解,难度不大,在热化学方程式中,反应热和方程式的系数成正比,注意理解弱电解质、氢氧化钠固体对中和热的影响.

 名校课堂系列答案
名校课堂系列答案| 化学键 | Cl-Cl | H-H | H-Cl | C-Cl | C-F | Si-Si | Si-O |
| 键能/kJ.mol-1 | 243 | 436 | 432 | 330 | 427 | 176 | 460 |
| A. | CCl4的稳定性小于CF4的稳定性 | |
| B. | CH4(g)跟Cl2(g)反应生成HCl(g)和CCl4(g)的反应是吸热反应 | |
| C. | 晶体硅的熔点低于SiO2 | |
| D. | 4 g H2和足量Cl2反应放出的热量为370 kJ/mol |
| A. | R是第三周期第ⅤA族的元素 | |
| B. | R的最高正化合价是+5 | |
| C. | R的氢化物分子式是RH5 | |
| D. | R的最高价氧化物的水化物的水溶液呈酸性 |
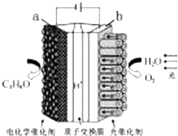 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化 为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化 为O2和燃料(C3H8O).下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | 该装置工作时,H+从b极区向a极区迁移 | |
| C. | 每生成1 mol O2,有44 g CO2被还原 | |
| D. | a 电极的反应为:3CO2+18H+-18e-═C3 H8O+5 H2 O |
| A. | 酸性HClO4>HBrO4>HIO4 | B. | 碱性NaOH>Mg(OH)2>Ca(OH)2 | ||
| C. | 稳定性:HI>H2S>HCl | D. | 氧化性:Na+>Mg2+>Al3+ |
| A. | 石油的分馏和煤的干馏均属物理变化 | |
| B. | BaSO4在医学上用做钡餐,Ba2+对人体无毒 | |
| C. | 14C可用于文物的年代鉴定,14C与12C互为同位素 | |
| D. | 常温下铁与浓硫酸中不能反应,故通常用铁罐盛装浓硫酸 |
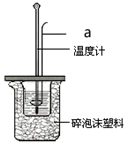 利用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液,在如图所示装置中测定中和热,回答下列问题:
利用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液,在如图所示装置中测定中和热,回答下列问题: