题目内容
5.硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑.
步骤2 向处理过的铁屑中加入过量的3mol•L-1H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液.
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体.
请回答下列问题:
第一节在步骤1的操作中,下列仪器中不必用到的有②④⑤(填仪器编号)
①铁架台 ②燃烧匙 ③锥形瓶 ④广口瓶 ⑤研钵 ⑥玻璃棒 ⑦酒精灯
第二节在步骤2中所加的硫酸必须过量,其原因是抑制亚铁离子的水解和氧化;
第三节在步骤3中,“一系列操作”依次为加热浓缩、冷却结晶和过滤;
第四节本实验制的硫酸亚铁铵晶体常含有Fe3+杂质.检验Fe3+的方法是取少量晶体溶于水配成溶液,取少量溶液加KSCN溶液,溶液显血红色.
分析 (1)步骤1是溶液的加热和过滤,结合加热与过滤基本操作选择仪器;
(2)亚铁离子在加热过程中会发生水解;
(3)步骤3是由溶液中获得晶体,是抑制亚铁离子的水解下的蒸发与结晶过程;
(4)检验Fe3+常用的试剂是KSCN溶液等,Fe3+与KSCN溶液反应,溶液显血红色,说明含有Fe3+.
解答 解:(1)步骤1是溶液的加热和过滤,需要的仪器有:铁架台、锥形瓶、玻璃棒、酒精灯,故不需要燃烧匙、广口瓶、研钵,
故选:②④⑤;
(2)亚铁离子在加热过程中会发生水解,因而要加酸抑制亚铁离子的水解,故所加的硫酸必须过量,
故答案为:加酸抑制亚铁离子的水解;
(3)步骤3是由溶液中获得晶体,亚铁离子在加热过程中会发生水解,应在抑制亚铁离子的水解情况下,加热浓缩、冷却结晶、过滤、洗涤等,
故答案为:加热浓缩、冷却结晶;
(4)检验Fe3+常用的试剂是KSCN溶液等,将晶体配成溶液,向溶液中滴入KSCN溶液,溶液显血红色,说明含有Fe3+,
故答案为:取少量晶体溶于水配成溶液,取少量溶液加KSCN溶液,溶液显血红色.
点评 本题考查溶液的加热、过滤、固体溶解、蒸发(防水解)、结晶等一系列实验基本操作、离子检验等,难度不大,是对所学知识的综合运用,注意基础知识的掌握.

练习册系列答案
相关题目
10.下列现象可能与环境污染有关的是( )
①冰雹 ②潮汐③酸雨④地震 ⑤臭氧层空洞⑥火山爆发 ⑦大脖子病 ⑧全球性气候变暖.
①冰雹 ②潮汐③酸雨④地震 ⑤臭氧层空洞⑥火山爆发 ⑦大脖子病 ⑧全球性气候变暖.
| A. | ③⑤⑧ | B. | ②③⑤⑥ | C. | ①③⑤⑦ | D. | ②③④⑦ |
13.下列各组中的性质比较,正确的是( )
| A. | 酸性HClO4>HBrO4>HIO4 | B. | 碱性NaOH>Mg(OH)2>Ca(OH)2 | ||
| C. | 稳定性:HI>H2S>HCl | D. | 氧化性:Na+>Mg2+>Al3+ |
20.丙烯酸(CH2=CH-COOH)的性质可能有( )
①加成反应 ②水解反应③酯化反应 ④中和反应 ⑤氧化反应 ⑥加聚反应.
①加成反应 ②水解反应③酯化反应 ④中和反应 ⑤氧化反应 ⑥加聚反应.
| A. | ①③④ | B. | ①③④⑤⑥ | C. | ①③⑥ | D. | ①②③④⑤ |
10.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 石油的分馏和煤的干馏均属物理变化 | |
| B. | BaSO4在医学上用做钡餐,Ba2+对人体无毒 | |
| C. | 14C可用于文物的年代鉴定,14C与12C互为同位素 | |
| D. | 常温下铁与浓硫酸中不能反应,故通常用铁罐盛装浓硫酸 |
14.烷烃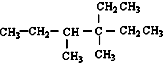 是由某单烯烃与H2加成后的产物,考虑烯烃的顺反异构,则这种单烯烃的结构可能有( )
是由某单烯烃与H2加成后的产物,考虑烯烃的顺反异构,则这种单烯烃的结构可能有( )
 是由某单烯烃与H2加成后的产物,考虑烯烃的顺反异构,则这种单烯烃的结构可能有( )
是由某单烯烃与H2加成后的产物,考虑烯烃的顺反异构,则这种单烯烃的结构可能有( )| A. | 3种 | B. | 4 | C. | 5种 | D. | 6种 |
15.下列反应属于加成反应的是( )
| A. | 甲烷与氯气混合光照 | B. | 苯、浓硝酸和浓硫酸混合共热 | ||
| C. | 用乙醇销毁金属钠 | D. | 乙烯使溴的四氯化碳溶液褪色 |
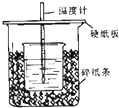 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: