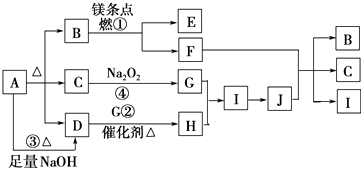
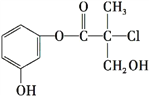
题目内容
【题目】向200mL 某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应测得最后溶液的pH>7。
(1)此时溶液的溶质如果是单一成分,可能是___________;如果是多种成分,可能是__________。
(2)在上述所得溶液中,逐滴缓慢滴加2 mol·L-1的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示:
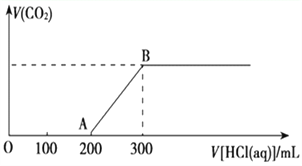
①加入盐酸200 mL之前,无气体产生,写出OA段发生反应的离子方程式:_______。
②B点时,反应所得溶液中溶质的物质的量浓度是_________ (溶液体积的变化忽略不计)。
【答案】 Na2CO3或NaHCO3 NaOH和Na2CO3、 Na2CO3和NaHCO3 OH-+H+=H2O,CO32-+H+=HCO3- 1.2 mol·L-1
【解析】试题分析:(1)CO2与NaOH反应可生成Na2CO3或NaHCO3,二者溶液都呈碱性,则如果是单一成分,可能是Na2CO3或NaHCO3;如果是多种成分,若1<n(NaOH)/n(CO2)<2,溶质是NaHCO3、Na2CO3;若n(NaOH)/n(CO2)>2,溶质是Na2CO3、NaOH。
(2)①加入盐酸200mL时开始生成气体,当加入盐酸300mL时不再产生气体,A→C段发生NaHCO3+HCl═NaCl+H2O+CO2↑,而O-A段消耗的盐酸为A→C的二倍,应为NaOH和Na2CO3的混合物,都可与盐酸反应,反应的离子方程式分别为OH-+H+═H2O、CO32-+H+═HCO3-。
②B点时,反应所得溶液中溶质为NaCl,由盐酸的物质的量可知为0.3L×2mol/L=0.6mol,则的物质的量浓度是0.6mol÷0.5L=1.2molL1。

练习册系列答案
相关题目