题目内容
【题目】图中A~J分别代表相关反应的一种物质.已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出.请填写以下空白: 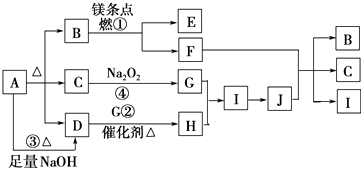
(1)A中含有的化学键是 .
(2)写出铜与J反应制取H的化学方程式:
(3)写出反应③的离子方程式: .
(4)写出物质B的电子式:;写出物质E的电子式: .
(5)在反应④中,当生成标况下22.4L 物质G时,转移电子数为mol.
【答案】
(1)离子键、极性共价键
(2)3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O
(3)NH4++HCO3﹣+2OH﹣ ![]() NH3↑+CO32﹣+2H2O
NH3↑+CO32﹣+2H2O
(4)![]() ;
;![]()
(5)2
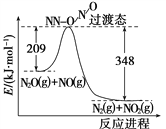
【解析】解:A受热能分解,分解得到等物质的量的B、C、D,且A与碱反应生成D,则A为酸式盐或铵盐,C能和过氧化钠反应,则C为水或二氧化碳,镁条能在B中燃烧,则B为二氧化碳或氧气,因为A受热分解生成B、C、D,则B为二氧化碳,C为水,水和过氧化钠反应生成NaOH和O2 , D能在催化剂条件下反应生成H,则D是NH3 , G是O2 , H是NO,I是NO2 , J是HNO3 , 镁和二氧化碳反应生成氧化镁和碳,C和浓硝酸反应生成二氧化碳、二氧化氮和水,则E是MgO,F是C,通过以上分析知,A为NH4HCO3 ,
(1.)A为NH4HCO3 , 铵根离子和碳酸氢根离子间含有离子键、铵根离子、碳酸氢根离子中含极性共价键,
所以答案是:离子键、极性共价键;
(2.)出铜与J为HNO3反应生成硝酸铜、一氧化氮和水,反应的化学方程式为:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,
所以答案是:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O;
(3.)反应③是在加热条件下,碳酸氢铵和氢氧化钠反应的离子方程式为:NH4++HCO3﹣+2OH﹣ ![]() NH3↑+CO32﹣+2H2O,
NH3↑+CO32﹣+2H2O,
所以答案是:NH4++HCO3﹣+2OH﹣ ![]() NH3↑+CO32﹣+2H2O;
NH3↑+CO32﹣+2H2O;
(4.)物质B为CO2 , 分子中碳原子和氧原子分别写出两个共价键,二氧化碳的电子式为: ![]() ,E为氧化镁属于离子化合物,电子式为:
,E为氧化镁属于离子化合物,电子式为: ![]() ,
,
所以答案是: ![]() ;
; ![]() ;
;
(5.)水和过氧化钠反应生成氢氧化钠和氧气,反应方程式为2Na2O2+2H2O=4NaOH+O2↑,当生成标况下22.4L 氧气时转移电子的物质的量= ![]() ×2×(1﹣0)=2mol,
×2×(1﹣0)=2mol,
所以答案是:2.

 名校课堂系列答案
名校课堂系列答案