题目内容
6.设NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 1L 1mol•L-1的盐酸中,含HCl分子数为NA | |
| B. | 0.1mol Na2O2与水完全反应,转移0.2NA个电子 | |
| C. | 8.4gNaHCO3固体中含HCO3-数目为0.1NA | |
| D. | 将含Na+数目为NA的NaCl固体溶于1L水中,所得溶液的浓度为1mol•L-1 |
分析 A、盐酸溶液中无HCl;
B、过氧化钠与水的反应为歧化反应;
C、取出碳酸氢钠的物质的量,然后根据1mol碳酸氢钠中含1molHCO3-;
D、溶液体积≠溶剂体积.
解答 解:A、盐酸溶液中无HCl分子,故A错误;
B、过氧化钠与水的反应为歧化反应,1mol过氧化钠转移1mol电子,故当0.1mol过氧化钠反应时,转移0.1mol电子即0.1NA个,故B错误;
C、8.4g碳酸氢钠的物质的量为0.1mol,而1mol碳酸氢钠中含1molHCO3-,故0.1mol碳酸氢钠中含0.1molHCO3-,个数为0.1NA个,故C正确;
D、溶液体积≠溶剂体积,故将氯化钠溶于1L水后,溶液体积大于1L,故溶液浓度小于1mol/L,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
16.常温下有0.1mol/L的以下几种溶液,①H2SO4溶液,②NaHSO4溶液,③CH3COOH溶液,④HCl溶液,⑤HCN溶液,⑥NH3•H2O,其中如下几种溶液的电离度(即已经电离的占原来总的百分数)如下表(已知H2SO4的第一步电离是完全的),回答下面问题:
(1)常温下,pH相同的表格中几种溶液,其物质的量浓度由大到小的顺序是③>②>④>①(填序号,下同)
(2)常温下,将足量的锌粉投人等体积pH=1的表格中几种溶液中,产生H2的体积(同温同压下)由大到小的顺序是③>②>①>④
(3)在25℃时,若用已知浓度的NaOH滴定未知浓度的CH3 COOH,若终点时溶液pH=a,则由水电离的.c(H+)为10-amol/L.
(4)25℃时,将amol NH4NO3溶于水,溶液显酸性,向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将逆向(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为$\frac{a}{200b}$mol•L-1.(NH3•H2O的电离平衡常数取Kb=2X10-5 mol•L-1)
| ①H2SO4溶液HSO4- | ②NaHSO4溶液HSO4- | ③CH3COOH | ④HCl溶液 |
| 10% | 29% | 1.33% | 100% |
(2)常温下,将足量的锌粉投人等体积pH=1的表格中几种溶液中,产生H2的体积(同温同压下)由大到小的顺序是③>②>①>④
(3)在25℃时,若用已知浓度的NaOH滴定未知浓度的CH3 COOH,若终点时溶液pH=a,则由水电离的.c(H+)为10-amol/L.
(4)25℃时,将amol NH4NO3溶于水,溶液显酸性,向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将逆向(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为$\frac{a}{200b}$mol•L-1.(NH3•H2O的电离平衡常数取Kb=2X10-5 mol•L-1)
17.为分别验证温度、浓度、催化剂颗粒大小对化学反应速率的影响规律,某同学设计了如下4组实验.
(1)上表中,反应速率最快的是实验2(填实验编号).
(2)实验3、4预期可得出的结论是催化剂颗粒越小,化学反应速率越大.
(3)设计实验2、3的目的是探究浓度对化学反应速率的影响.
(4)设计一个实验证明在其他条件相同时,改变温度对过氧化氢分解速率的影响(写出操作步骤):取相同浓度的过氧化氢溶液,控制催化剂相同,分别在在不同温度下加热,观察产生气体的快慢.
| 实验序号 | 温度 /℃ | H2O2溶液 初始浓度/% | MnO2 颗粒大小 |
| 1 | 25 | 4 | 无MnO2 |
| 2 | 25 | 12 | 1g细颗粒MnO2 |
| 3 | 25 | 4 | 1g细颗粒MnO2 |
| 4 | 25 | 4 | 1g粗颗粒MnO2 |
(2)实验3、4预期可得出的结论是催化剂颗粒越小,化学反应速率越大.
(3)设计实验2、3的目的是探究浓度对化学反应速率的影响.
(4)设计一个实验证明在其他条件相同时,改变温度对过氧化氢分解速率的影响(写出操作步骤):取相同浓度的过氧化氢溶液,控制催化剂相同,分别在在不同温度下加热,观察产生气体的快慢.
14.下列溶液蒸干后,能析出溶质固体的是( )
①AlCl3 ②Fe2(SO4)3 ③Ca(HCO3)2 ④Na2CO3.
①AlCl3 ②Fe2(SO4)3 ③Ca(HCO3)2 ④Na2CO3.
| A. | 仅①④ | B. | 仅②④ | C. | 仅①② | D. | 全部 |
11.高效能电池的研发制约电动汽车的推广.有一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应式为:2C2H6+7O2+8KOH═4K2CO3+10H2O,有关此电池的推断正确的是( )
| A. | 负极反应为:14H2O+7O2+28e-═28OH- | |
| B. | 放电过程中KOH的物质的量浓度不变 | |
| C. | 每消耗1 mol C2H6,则电路上转移的电子为14 mol | |
| D. | 放电一段时间后,负极周围的碱性增强 |
15.下列物质中同分异构体(不考虑立体异构)最多的是( )
| A. | 乙醇 | B. | 戊烷 | C. | 二氯丙烷 | D. | 戊烯 |
16.下列说法正确的是( )
(1)增加水的量或升高温度,一定可以加快镁跟水的反应速率
(2)增大硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率
(3)对于反应CaCO3(s)?CaO(s)+CO2(g),增加CaCO3的量,可以加快正反应速率,而增加CaO或CO2的浓度,则可以加快逆反应速率
(4)对于反应3H2(g)+N2(g)?2NH3(g),在密闭容器中进行(固定体积),现充入氦气,由于容器中压强增大,则化学反应速率加快
(5)对于反应3H2(g)+N2(g)?2NH3(g),使用适合催化剂,正逆反应速率同等程度加快.
(1)增加水的量或升高温度,一定可以加快镁跟水的反应速率
(2)增大硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率
(3)对于反应CaCO3(s)?CaO(s)+CO2(g),增加CaCO3的量,可以加快正反应速率,而增加CaO或CO2的浓度,则可以加快逆反应速率
(4)对于反应3H2(g)+N2(g)?2NH3(g),在密闭容器中进行(固定体积),现充入氦气,由于容器中压强增大,则化学反应速率加快
(5)对于反应3H2(g)+N2(g)?2NH3(g),使用适合催化剂,正逆反应速率同等程度加快.
| A. | (1)(2) | B. | (1)(2)(3) | C. | (1)(2)(3)(4) | D. | (5) |
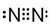 ;
;