题目内容
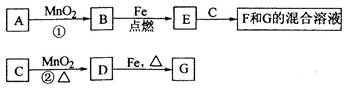
A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。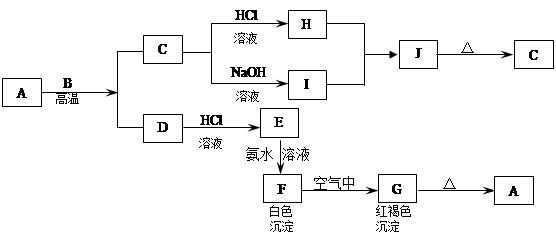
(1)A的化学式是 。
(2)F在空气中转化为G的化学方程式: 。
(3)C转化为I的离子方程式: 。
(4)D转化为E的离子方程式: 。
(5)D在高温下和水蒸气反应的化学方程式: 。
(1)Fe2O3 (2)4 Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)Al2O3+2OH-=2AlO2-+H2O (4)Fe+2H+=Fe2++H2↑(5)3Fe+4H2O(g)  Fe3O4+4H2
Fe3O4+4H2
解析试题分析:化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。A是一种红棕色金属氧化物,则A应该是氧化铁。B、D是金属单质,且A能和B反应生成D,因此该反应应该是铝热反应,即B是铝,D是铁,C是氧化铝。氧化铝是两性氧化物,能和盐酸以及氢氧化钠溶液均反应,所以H是氯化铝,I是偏铝酸钠。二者反应生成氢氧化铝白色沉淀,即J是氢氧化铝。氢氧化铝不稳定,加热易分解生成氧化铝。铁是活泼的金属与盐酸反应生成氯化亚铁和氢气,即E是氯化亚铁。氯化亚铁和氨水反应生成氢氧化亚铁白色沉淀,则F是氢氧化亚铁。氢氧化亚铁极易被氧气氧化生成氢氧化铁,即G是氢氧化铁。氢氧化铁加热分解生成氧化铁和水。根据以上分析可知;
(1)A的化学式是Fe2O3。
(2)F在空气中转化为G的化学方程式为4 Fe(OH)2+O2+2H2O=4Fe(OH)3。
(3)C转化为I的离子方程式为Al2O3+2OH-=2AlO2-+H2O。
(4)D转化为E的离子方程式为Fe+2H+=Fe2++H2↑。
(5)D在高温下和水蒸气反应的化学方程式为3Fe+4H2O(g)  Fe3O4+4H2。
Fe3O4+4H2。
考点:考查无机框图题的推断

A~H均为短周期元素,A~F在元素周期表中的相对位置如图1所示,G与其它七种元素
| 图1 | |||
| A | B | C | |
| D | | E | F |
| 图2 | |||
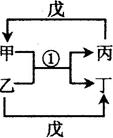 | |||
不在同一周期,H是短周期中原子半径最大的主族元素。由B、G构成的最简单化合物常为氮肥工业和纯碱工业的原料。由上述某些元素组成的物质甲~戊的转化关系如图2所示。请回答下列问题:
(1)已知图2中反应①是复分解反应,生成物中水已略去。
a.若戊是含有18电子的双原子分子,则甲的电子式为:_________。实验室制取气体丙的化学方程式为:___________________________。
b.若甲的水溶液呈碱性,丙的凝胶经干燥脱水后,常用做干燥剂,写出甲的一种用途 。
c.若将a和b中甲的饱和溶液混合,会出现白色胶状沉淀,同时伴有刺激性气味的气体产生,则该反应的离子方程式: 。
(2)已知图2中反应①是置换反应,戊是单质,则戊可能是 或 ,分别写出一个对应的反应①的化学方程式 、 。