题目内容
【题目】高炉炼铁过程中发生的主要反应为:![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g);在1000℃时,平衡常数为4.0;在1300℃时,平衡常数为3.5。下列说法中,正确的是( )
Fe(s)+CO2(g);在1000℃时,平衡常数为4.0;在1300℃时,平衡常数为3.5。下列说法中,正确的是( )
A. 平衡常数的表达式为:K=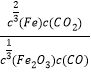
B. 在1000℃时,10L的密闭容器中,加入Fe、Fe2O3、CO、CO2各1mol,10min达到平衡,υ(CO2)=0.006mol/(L·min)
C. 一段时间以后,铁的量不再变化,不能说明该反应达到平衡
D. 下图表示不同温度下,CO的转化率与时间关系图像
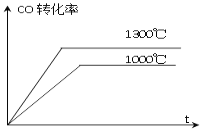
【答案】B
【解析】
A.反应为:1/3 Fe2O3(s)+CO(g)![]() 2/3Fe(s)+CO2(g);平衡常数的表达式为:K=c(CO2)/c(CO), A错误;
2/3Fe(s)+CO2(g);平衡常数的表达式为:K=c(CO2)/c(CO), A错误;
B. 在1000℃时,令平衡时CO的物质的量变化为nmol,容器的体积为10L;则:
1/3 Fe2O3(s)+CO(g)![]() 2/3Fe(s)+CO2(g)
2/3Fe(s)+CO2(g)
起始量 1 1
变化量 n n
平衡量 1-n 1+ n
K=c(CO2)/c(CO)= [(1+ n)÷10]/[(1-n)÷10]=4, n=0.6mol, υ(CO2)=0.6/(10×10)= 0.006mol/(L·min), B正确;
C. 反应的不断进行,铁的量就在发生变化,一段时间以后,铁的量不再变化,说明该反应达到平衡状态,C错误;
D. 在1000℃时,平衡常数为4.0;在1300℃时,平衡常数为3.5,温度升高,平衡常数减小,所以该反应正反应为放热反应,升高温度,速率加快,平衡左移,CO的转化率应该降低,而图示的结果正好相反,D错误;
正确选项B。

【题目】草酸晶体的组成可表示为H2C2O4·xH2O,某研究性学习小组用下图装置进行“草酸晶体受热分解的部分产物的验证”的实验。请回答下列问题。

【资料查阅】
①草酸晶体在101 ℃时开始熔化,150 ℃时开始升华,175 ℃时开始分解;
②草酸钙和草酸氢钙均为白色不溶物。
(1)按照如图所示的装置,通过实验检验草酸晶体的部分分解产物,装置B中可观察到有气泡冒出且澄清石灰水变浑浊,由此甲同学判断草酸晶体分解的产物中有CO2。但立即遭到乙同学反对,其反对的理由可能是______________________________________。
(2)丙同学认为草酸晶体分解的产物中含有CO,为进行验证,X应选用________(填化学式)浓溶液,装置D的作用是____________________。
(3)实验过程中涉及如下操作:①点燃装置A处的酒精灯;②熄灭装置A处的酒精灯;③点燃装置E处的酒精灯;④熄灭装置E处的酒精灯。这4步操作由先到后的顺序为____________(填序号)。点燃E处酒精灯前必须要进行的操作是______________。
(4)实验过程中发现装置E中黑色粉末变红色,装置F中有黑色固体生成,经检测装置F中的固体为金属单质,则装置F中发生反应的化学方程式为________________________________________________________________________。
(5)丁同学用滴定法测定草酸晶体中结晶水的含量,进行了下列操作:
步骤一:用分析天平称取3.15 g纯净的该草酸晶体,配制成250 mL溶液。
步骤二:用移液管移取25.00 mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化。
步骤三:取0.100 mol·L-1标准酸性KMnO4溶液,进行滴定,三次结果如下表所示:
第一次 | 第二次 | 第三次 | |
待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
标准溶液体积(mL) | 9.99 | 10.01 | 10.00 |
已知滴定反应的离子方程式为:MnO![]() +H2C2O4+H+―→Mn2++CO2↑+H2O(未配平)。
+H2C2O4+H+―→Mn2++CO2↑+H2O(未配平)。
①配制草酸溶液的操作步骤依次是:将晶体置于烧杯中,加水溶解,将溶液转移入________,洗涤,定容,摇匀。
②通过计算确定x=________。




