��Ŀ����
����Ŀ�����ᾧ�����ɿɱ�ʾΪH2C2O4��xH2O��ij�о���ѧϰС������ͼװ�ý��������ᾧ�����ȷֽ�IJ��ֲ������֤����ʵ�顣��ش��������⡣

�����ϲ��ġ�
�����ᾧ����101 ��ʱ��ʼ�ۻ���150 ��ʱ��ʼ������175 ��ʱ��ʼ�ֽ⣻
������ƺͲ�����ƾ�Ϊ��ɫ�����
��1��������ͼ��ʾ��װ����ͨ��ʵ�������ᾧ��IJ��ַֽ������װ��B�пɹ۲쵽������ð���ҳ���ʯ��ˮ��������ɴ˼�ͬѧ�жϲ��ᾧ��ֽ�IJ�������CO2�����������ͬѧ�������䷴�Ե����ɿ�����______________________________________��
��2����ͬѧ��Ϊ���ᾧ��ֽ�IJ����к���CO��Ϊ������֤��XӦѡ��________(�ѧʽ)Ũ��Һ��װ��D��������____________________��
��3��ʵ��������漰���²������ٵ�ȼװ��A���ľƾ��ƣ���Ϩ��װ��A���ľƾ��ƣ��۵�ȼװ��E���ľƾ��ƣ���Ϩ��װ��E���ľƾ��ơ���4���������ȵ����˳��Ϊ____________(�����)����ȼE���ƾ���ǰ����Ҫ���еIJ�����______________��
��4��ʵ������з���װ��E�к�ɫ��ĩ���ɫ��װ��F���к�ɫ���������������װ��F�еĹ���Ϊ������������װ��F�з�����Ӧ�Ļ�ѧ����ʽΪ________________________________________________________________________��
��5����ͬѧ�õζ����ⶨ���ᾧ���нᾧˮ�ĺ��������������в�����
����һ���÷�����ƽ��ȡ3.15 g�����ĸò��ᾧ�������Ƴ�250 mL��Һ��
�����������Һ����ȡ25.00 mL���������Һ����ƿ�������������������ữ��
��������ȡ0.100 mol��L��1������KMnO4��Һ�����еζ������ν�����±���ʾ��
��һ�� | �ڶ��� | ������ | |
������Һ���(mL) | 25.00 | 25.00 | 25.00 |
����Һ���(mL) | 9.99 | 10.01 | 10.00 |
��֪�ζ���Ӧ�����ӷ���ʽΪ��MnO![]() ��H2C2O4��H���D��Mn2����CO2����H2O(δ��ƽ)��
��H2C2O4��H���D��Mn2����CO2����H2O(δ��ƽ)��
�����Ʋ�����Һ�IJ������������ǣ������������ձ�������ˮ�ܽ�������Һת����________��ϴ�ӣ����ݣ�ҡ�ȡ�
��ͨ������ȷ��x��________��
���𰸡� �ӷ����IJ��������ʯ��ˮ��ӦҲ������ͬ������(����Ϊ����ơ�������ƶ�Ϊ��ɫ����) NaOH ����CO(���ȥCO�е�ˮ����) �٢ۢܢ� ����CO�Ĵ��� PdCl2��H2O��CO===Pd����CO2��2HCl 250 mL����ƿ 2
����������1�����ᾧ����101��ʱ��ʼ�ۻ���150��ʱ��ʼ��������˼��ȷֽ�ʱ���ӷ����IJ��������ʯ��ˮ��ӦҲ������ɫ��������ȷ�𰸣��ӷ����IJ��������ʯ��ˮ��ӦҲ������ͬ��������Ϊ����ơ�������ƶ�Ϊ��ɫ��������
��2���������ȷֽ������ܲ���CO��CO2�����������֤CO����֮ǰ���ȳ�ȥCO2��XӦѡ��NaOH��Һ�� �����CO�ܹ���ԭ����ͭ�������������Ũ�������CO��������ȷ����NaOH������CO��������ȥCO�е�ˮ��������
��3���ȵ�ȼA���ľƾ��ƣ��������壬�ž�װ���ڿ�����Ȼ�����Eװ�÷�Ӧ��������Ӧ��������Ϩ��E���ƾ��ƣ���ȴ�����º���Ϩ��A���ľƾ��ƣ��Է�����������������4���������ȵ����˳��Ϊ�٢ۢܢ�����ȼE���ƾ���ǰ����Ҫ���еIJ����Ǽ���CO�Ĵ��ȣ���ȷ�𰸣��٢ۢܢ�������CO�Ĵ��ȣ������֡��鴿������
��4��PdCl2������CO��Ӧ���ɽ���Pd��CO������ΪCO2����ѧ����ʽΪPdCl2��H2O��CO=== Pd����CO2��2HCl����ȷ����PdCl2��H2O��CO=== Pd����CO2��2HCl��
��5������KMnO4��Һ�����Ϊ9.99+10.01+10.00=10.00mL������KMnO4����Ϊ0.10��10��10-3=10-3 mol��25 mL������Һ����KMnO410-3 mol��250 mL������Һ����KMnO410-2 mol����Ӧ���£�2MnO4��+5H2C2O4+6H+=2Mn2++10CO2��+8H2O�����ݷ�Ӧ��ϵ2MnO4��--5H2C2O4������H2C2O4����Ϊ2.5��10-2 mol��3.15g����H2C2O4��xH2O����Ϊ2.5��10-2 mol��3.15/(90+18x)= 2.5��10-2, x=2����ȷ����2��

����Ŀ������ͼ�е�ʵ�鷽�����ܴﵽʵ��Ŀ�ĵ���
ѡ�� | ʵ�鷽�� | ʵ��Ŀ�� |
A |
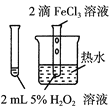
| ��֤FeCl3��H2O2�ֽⷴӦ�д����� |
B |
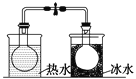
��NO2������ڱ�ˮ����ˮ�� | ̽���¶ȶ�ƽ��2NO2 |
C |
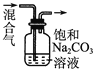
| ��ȥCO2�����л��е�SO2 |
D |
| �Ƚ�HCl��H2CO3��H2SiO3������ǿ�� |
A. A B. B C. C D. D