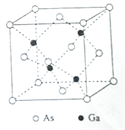
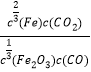题目内容
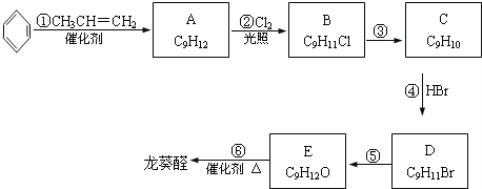
【题目】龙葵醛(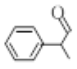 )是一种珍贵的香料,广泛应用于香料、医药、染料及农药等行业。以下是以苯为原料生成龙葵醛的一种合成路线(部分反应条件及副产物已略去):
)是一种珍贵的香料,广泛应用于香料、医药、染料及农药等行业。以下是以苯为原料生成龙葵醛的一种合成路线(部分反应条件及副产物已略去):
(1)龙葵醛的分子式为_______,其中官能团的名称是__________;
(2)A物质的核磁共振氢谱中有_______个吸收峰,B的结构简式可能为_______。
(3)反应③的反应类型为_______,反应⑤的反应条件为_______。
(4)反应⑥的化学方程式为___________。
(5)龙葵醛具有多种同分异构体,其中某些物质有下列特征:a.其水溶液遇FeCl3溶液呈紫色;b.能与Br2的CCl4发生加成反应。则符合上述条件的物质可能的结构有_______种。其中核磁共振氢谱为五组峰,峰面积比为1∶2∶2∶2∶3的结构简式为_______。
【答案】 C9H10O 醛基 5 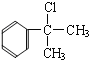 或
或![]() 消去 NaOH水溶液加热 2
消去 NaOH水溶液加热 2![]() +O2
+O2![]() 2
2![]() +2H2O 19
+2H2O 19 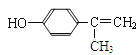
【解析】分析:根据题中各物质转化关系,比较苯和A的分子式以及其它各物质的分子式可知,反应①为加成反应,A在光照条件下发生侧链上取代生成B,B发生消去反应生成C,C与溴化氢发生加成反应生成D,D在碱性条件下加热,发生水解反应生成E,E发生氧化反应生成龙葵醛,根据龙葵醛的结构可反推得E为![]() ,D为
,D为![]() ,C为
,C为![]() ,B为
,B为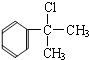 或
或![]() ,A为
,A为![]() ,据此解答。
,据此解答。
详解:(1)根据龙葵醛的结构简式可知分子式为C9H10O,其中含氧官能团的名称是醛基;
(2)A为![]() ,A分子中含有5种氢原子,则A物质的核磁共振氢谱中有5个吸收峰;根据以上分析可知B的结构简式可能为
,A分子中含有5种氢原子,则A物质的核磁共振氢谱中有5个吸收峰;根据以上分析可知B的结构简式可能为 或
或![]() ;
;
(3)根据以上分析可知反应③的反应类型为消去反应,反应⑤为D在碱性条件下加热,发生水解反应生成E,所以反应条件为NaOH的水溶液、加热;
(4)反应⑥是羟基的催化氧化,则反应的化学方程式为2![]() +O2
+O2![]() 2
2![]() +2H2O;
+2H2O;
(5)龙葵醛的同分异构体中a.其水溶液遇FeCl3溶液呈紫色,说明有酚羟基;b.能与Br2的CCl4发生加成反应,说明含有碳碳双键。根据苯环上含有2个取代基,应该是-OH与-CH=CHCH3或-OH与-CH2CH=CH2或-OH与-C(CH3)=CH2,均有邻间对三种;如果含有3个取代基,应该是-OH、-CH3、-CH=CH2,有10种,合计是19,其中核磁共振氢谱为五组峰,峰面积比为1∶2∶2∶2∶3的结构简式为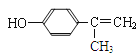 。
。

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案【题目】下列实验现象的描述中不正确的是( )
选项 | 实验 | 现象 |
A | 加热放在坩埚中的一小块钠 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
B | 在酒精灯上加热铝箔 | 铝箔熔化时失去光泽,熔化的铝并不滴落好像有一层膜包着 |
C | 点燃的镁条伸入盛有O2的集气瓶(底部铺有少量细沙)中 | 镁条继续燃烧,发出耀眼的白光,放出大量的热,生成白色固体 |
D | 在空气中久置的铝条放入NaOH溶液中 | 立刻产生大量无色气泡,铝条逐渐变细,放出大量的热 |
A. A B. B C. C D. D