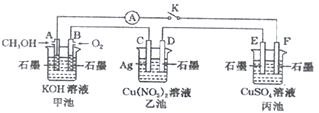
题目内容
【题目】工业上利用氯碱工业中的固体废物盐泥(主要成分为Mg(OH)2、CaCO3、BaSO4,除此之外还有NaCl、Al(OH)3、Fe(OH)3、Mn(OH)2等。)与废稀硫酸反应制备七水硫酸镁,产率高,既处理了三废,又有经济效益。其工艺流程如下:

已知:
i)部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
pH值(完全沉淀) | 10.02 | 8.96 | 3.20 | 4.70 | 11.12 |
ii)两种盐的溶解度图(单位为g/100g水)
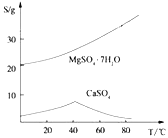
根据以上流程图并参考表格pH数据和溶解度图,请回答下列问题。
(1)酸解时,加入的酸为____________,在酸解过程中,想加快酸解速率,请提出两种可行的措施____________、____________。
(2)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式是____________。
(3)本工艺流程多次用到抽滤操作,其优点在于____________,四次抽滤时:抽滤①所得滤渣A的成分为____________、CaSO4;抽滤②所得滤渣B的成分为MnO2、____________、____________;抽滤③所得滤液C中主要杂质阳离子的检验方法是____________;抽滤④将产品抽干。
(4)依据溶解度曲线,操作M应采取的方法是适当浓缩,____________。
(5)每制备1吨MgSO4·7H2O,需要消耗盐泥2吨。若生产过程中的转化率为70%,则盐泥中镁(以氢氧化镁计)的质量分数约为____________。
【答案】 硫酸 升温 把盐泥粉碎、搅拌等 Mn2++ ClO-+ H2O == MnO2↓ + 2H++ Cl- 速度快 BaSO4 Fe(OH)3 Al(OH)3 焰色反应 趁热过滤 16.8%(16%、17%均可给分)
【解析】(1)因最终产物为MgSO4·7H2O,所以酸解时应加入硫酸,为加快酸解速率,可采用粉碎、搅拌或适当加热等措施。
(2)已知NaClO可与Mn2+反应产生MnO2沉淀,根据化合价变化规律,则ClO—转化为Cl—,所以反应的离子方程式为Mn2++ ClO-+ H2O == MnO2↓ + 2H++ Cl-。
(3)抽滤操作的优点是过滤速率快;在强酸性条件下过滤得滤渣A,所以其主要成分为BaSO4和CaSO4;在pH=5~6的条件下过滤得滤渣B,根据氢氧化物沉淀完全的pH可知:滤渣B的主要成分为Al(OH)3、Fe(OH)3、MnO2;滤液C中的主要成分为Na2SO4、MgSO4 和少量的CaSO4,其主要杂质阳离子为Na+,可用焰色反应检验。
(4)依据溶解度曲线,CaSO4在40℃左右溶解度最大,在80℃左右溶解度最小,所以操作M应采取的方法适当浓缩、趁热过滤,尽可能多的除去CaSO4。
(5)根据镁元素守恒可得:n(MgSO4·7H2O)= n[Mg(OH)2],所以盐泥中Mg(OH)2的质量分数为= 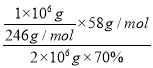 ×100%=16.8%
×100%=16.8%

 名校课堂系列答案
名校课堂系列答案【题目】现有6瓶失去标签的液体,已知它们可能是乙醇、乙酸、苯、乙酸乙酯、油脂、葡萄糖中的一种。现通过如下实验来确定各试剂瓶中所装液体的名称:
实验步骤和方法 | 实验现象 |
①把6瓶液体分别依次标号A、B、C、D、E、F,然后闻气味 | 只有F没有气味 |
②各取少量于试管中 ,加水稀释 | 只有C、D、E不溶解而浮在水面上 |
③分别取少量6种液体于试管中,加新制Cu(OH)2并加热 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
④各取C、D、E少量于试管中,加稀NaOH溶液并加热 | 只有C仍有分层现象,且在D的试管中闻到特殊香味 |
(1)写出这6种物质的名称。
A____________ B____________ C____________ D____________ E____________ F____________
(2)在D中加入NaOH溶液并加热的化学方程式为__________________