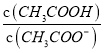题目内容
【题目】pH是溶液中c(H+)的负对数,若定义pc是溶液中溶质物质的量浓度的负对数,则常温下,某浓度的草酸(H2C2O4)水溶液中pc(H2C2O4)、pc(HC2O4-)、pc(C2O42-)随着溶液pH的变化曲线如图所示:己知草酸的电离常数Ka1=5.6×10-2,Ka2=5.4×10-5 下列叙述正确的是( )

A. 曲线I表示H2C2O4的变化
B. pH=4时,c(HC2O4-)>c(C2O42-)
C. c(H2C2O4)+c(HC2O4-)+c(C2O42-)在a点和b点一定相等
D. 常温下,  随pH的升高先增大后减小
随pH的升高先增大后减小
【答案】BC
【解析】H2C2O4H++HC2O4-,HC2O4-H++C2O42-,pH增加促进电离平衡正向移动,所以由图可知:曲线Ⅰ是HC2O4-的物质的量浓度的负对数,曲线Ⅱ是H2C2O4的物质的量浓度的负对数,曲线Ⅲ是C2O42-的物质的量浓度的负对数。A、曲线Ⅰ表示HC2O4-的物质的量浓度的负对数的变化,而不是H2C2O4的变化,故A错误;B、pH=4时,pc(C2O42-)>pc(HC2O4-),所以c(HC2O4-)>c(C2O42-),故B正确;C、根据物料守恒,c(H2C2O4)+c(HC2O4-)+c(C2O42-)在a点和b点一定相等,故C正确;D、常温下,  的分子和分母同乘以氢离子的浓度,即为
的分子和分母同乘以氢离子的浓度,即为![]() ,只要温度不变,比值不变,故D错误;故选BC。
,只要温度不变,比值不变,故D错误;故选BC。

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目