题目内容
【题目】利用电解技术,以氯化氢为原料回收氯气的过程如图所示,下列说法不正确的是
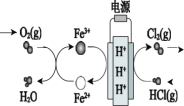
A.H+由阳极区向阴极区迁移
B.阴极电极反应:Fe3+ + e- =Fe2+
C.阴极区发生的反应有:4Fe2+ + O2 + 4H+ =4Fe3+ + 2H2O
D.阳极电极反应:2HCl + 2e- = Cl2 + 2H+
【答案】D
【解析】
在电源的右侧,HCl(g)→Cl2(g),该过程是失电子的过程,故该侧为阳极,电极反应为:2HCl-2e-=2H++Cl2,电源的左侧为阴极,电极反应为:Fe3++e-=Fe2+;此外,根据物质的循环,还可以推出阴极区域还会进行反应:4Fe2++O2+4H+=4Fe3+ +2H2O。
A.H+在电源的右侧产生,在电源的左侧被消耗,右侧为阳极,左侧为阴极,即H+由阳极区向阴极区迁移,故A正确;
B.阴极发生还原反应,是Fe3+得到电子的过程,电极反应为:Fe3++e-=Fe2+,故B正确;
C.根据图中的循环,推出阴极区域会进行反应:4Fe2++O2+4H+=4Fe3+ +2H2O,故C正确;
D.阳极发生氧化反应,是HCl失去电子的过程,电极反应为:2HCl-2e-=2H++Cl2,故D错误;
故选D。

练习册系列答案
相关题目
【题目】纪录片《我在故宫修文物》表现了文物修复者穿越古今与百年之前的人进行对话的职业体验,让我们领略到历史与文化的传承。下列文物修复和保护的过程中涉及化学变化的是( )
A | B | C | D |
|
|
|
|
银器用除锈剂除锈 | 变形的金属香炉复原 | 古画水洗除尘 | 木器表面擦拭烫蜡 |
A.AB.BC.CD.D