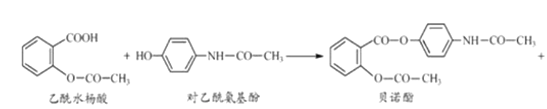
题目内容
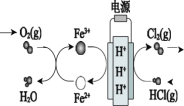
【题目】铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法正确的是
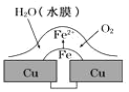
A.阳极电极反应式为:2H++2e→H2↑
B.此过程中电子从 Fe 移向 Cu,铁铆钉发生还原反应
C.此过程中铜会被腐蚀,发生氧化反应
D.此过程中铁做负极,被氧化
【答案】D
【解析】
水中溶解了氧气,铜、铁和水构成了原电池,较活泼的金属作负极,较不活泼的金属作正极,发生吸氧腐蚀,负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-=Fe2+,正极上氧气得电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁不稳定,容易被空气中的氧气氧化生成氢氧化铁,反应方程式为:4Fe(OH)2+2H2O+O2=4Fe(OH)3,原电池放电时,电子从负极流向正极。
A.正极上氧气得电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,故A错误;
B.此过程中电子从 Fe 移向 Cu,负极上发生的电极反应式为:Fe-2e-=Fe2+,铁铆钉发生氧化反应,故B错误;
C.该原电池中铜作正极,原电池放电时,负极失电子容易被腐蚀,正极被保护,所以铜不被腐蚀,故C错误;
D.此过程中铁做负极,电极反应式为:Fe-2e-=Fe2+,铁铆钉发生氧化反应,故D正确;
故选D。

 每课必练系列答案
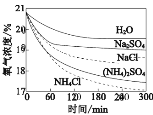
每课必练系列答案【题目】利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。
实验装置 | 实验编 号 | 浸泡液 | pH | 氧气浓度随时间的变化 |
| ① | H2O | 7 |
|
② | 1.0 mol·L-1 NH4Cl | 5 | ||
③ | 0.5 mol·L-1 (NH4)2SO4 | 5 | ||
④ | 1.0 mol·L-1 NaCl | 7 | ||
⑤ | 0.5 mol·L-1Na2SO4 | 7 |
下列说法不正确的是
A.①与④⑤比较说明盐溶液可以加快吸氧腐蚀速率
B.向实验②溶液中加等体积的 0.5 mol·L-1 (NH4)2SO4,吸氧腐蚀速率一定加快
C.②与③、④与⑤比较说明吸氧腐蚀速率可能与阴离子种类有关
D.向实验⑤溶液中加入少量(NH4)2SO4 固体,吸氧腐蚀速率加快