题目内容
16.下列热化学方程式中△H代表燃烧热的是( )| A. | CH4 ( g )+$\frac{3}{2}$O2( g )═2H2O ( l )+CO ( g )△H1 | |
| B. | S ( s )+$\frac{3}{2}$O2 ( g )═SO3 ( s )△H2 | |
| C. | C6H12O6 ( s )+6O2 ( g )═6CO2 (g)+6H2O ( l )△H3 | |
| D. | 2CO ( g )+O2( g )═2CO2 ( g )△H4 |
分析 物质的燃烧热,通常在25℃,101 kPa时,1 mol可燃物完全燃烧生成稳定的化合物时所放出的热量,据此解答.
解答 解:A.反应物中碳元素应生成CO2,故A错误;
B.硫燃烧生成二氧化硫,故B错误;
C.可燃物C6H12O6(s)的物质的量是1 mol,反应中C→CO2,H→H2O(液),反应放出的热量是燃烧热,故C正确;
D.CO的化学计量数应为1,故D错误;
故选:C.
点评 本题考查了燃烧热化学方程式的书写,明确燃烧热的概念是解题关键,注意可燃烧的物质系数为1,生成产物必须是最稳定的氧化物,题目难度不大.

练习册系列答案
相关题目
7.下列有关化学用语表示正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | B. | 乙酸的结构式:CH3COOH | ||
| C. | 2-丁烯的键线式: | D. | 乙醇分子的比例模型: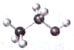 |
11.某同学用图中四种装置从海带里提取取碘,其中正确且能达到实验目的是( )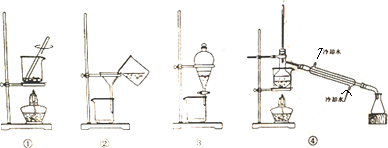

| A. | 装置①将海带灼烧成灰 | B. | 装置②过滤含I-的溶液 | ||
| C. | 装置③放出碘的CCl4溶液 | D. | 装置④分离碘并回收CCl4 |
1.下列叙述正确的是( )
| A. | 1.00molNaCl中含有6.02×1023个NaCl分子 | |
| B. | 1.00molNaCl中,所有的Na+的最外层电子总数8×6.02×1023 | |
| C. | 欲配制1L1.00mol/L的NaCl溶液,可将58.5gNaCl溶于1.00L水中 | |
| D. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
8.25℃,向20mL 0.1mol•L-1的H3PO2溶液中滴加0.1mol•L-1的NaOH溶液(滴定过程中溶液温度保持不变),滴定曲线如图1,含磷物种浓度所占分数(δ)随pH变化关系如图2,则下列说法不正确的是( )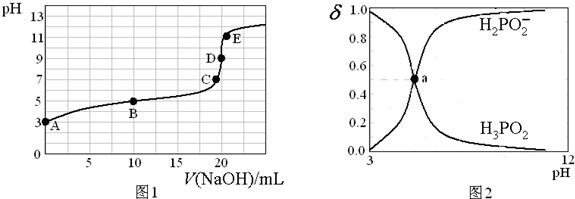

| A. | H3PO2的电离方程式为:H3PO2?H2PO2-+H+;电离常数Ka≈10-5 | |
| B. | B点溶液中存在关系:2c(H+)+c(H3PO2)=2c(OH-)+c(H2PO2-) | |
| C. | 图2中的a点对应为 图1中的B点 | |
| D. | D点时,溶液中微粒浓度大小关系为:c(Na+)>c(H2PO2-)>c(OH-)>c(H+) |
6.下列各种说法中正确的是( )
| A. | 乙烯和甲苯都能使酸性高锰酸钾溶液褪色 | |
| B. | 凡是能起银镜反应的物质一定是醛 | |
| C. | 在酯化反应中,羧酸脱去羧基中的氢原子,醇脱去羟基生成水和酯 | |
| D. | 苯酚有弱酸性,因此它是一种羧酸 |
 图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题: