题目内容
1.现有两种气体,它们的分子量分别为MA、MB.(1)当两种气体质量相同时,标准状况下A与B的体积比为MB:MA,密度比为MA:MB,所含分子数比为MB:MA;
(2)当两种气体(同温同压)的体积相同时,A和B的质量比是MA:MB.
分析 (1)根据n=$\frac{m}{M}$计算二者物质的量之比,相同条件下,气体体积之比等于其物质的量之比,气体密度之比等于相对分子质量之比,分子数目之比等于物质的量之比;
(2)同温同压下,气体体积之比等于物质的量之比,再根据m=nM计算.
解答 解:(1)根据n=$\frac{m}{M}$可知,相同质量A、B的物质的量之比为MB:MA,相同条件下,气体体积之比等于其物质的量之比,则标准状况下A与B的体积比为MB:MA,相同条件下,气体密度之比等于相对分子质量之比,故A与B的密度之比为MA:MB,由N=nNA可知,A、B分子数目之比为MB:MA,
故答案为:MB:MA;MA:MB;MB:MA;
(2)同温同压下,A、B气体的体积相等,则二者物质的量相等,根据m=nM可知,A、B质量之比为MA:MB,
故答案为:MA:MB.
点评 本题考查物质的量有关计算、阿伏伽德罗定律及其推论,比较基础,注意对公式的理解与灵活应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.分子式与苯丙氨酸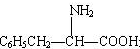 相同,且同时符合下列两个条件:①有带有两个取代基的苯环②有一个硝基直接连在苯上,这样的同分异构体数目有( )
相同,且同时符合下列两个条件:①有带有两个取代基的苯环②有一个硝基直接连在苯上,这样的同分异构体数目有( )
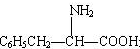 相同,且同时符合下列两个条件:①有带有两个取代基的苯环②有一个硝基直接连在苯上,这样的同分异构体数目有( )
相同,且同时符合下列两个条件:①有带有两个取代基的苯环②有一个硝基直接连在苯上,这样的同分异构体数目有( )| A. | 3个 | B. | 5个 | C. | 6个 | D. | 10个 |
12.下列有关化学反应表达正确的是( )
| A. | 实验室用液溴和苯在催化剂作用下制溴苯: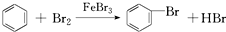 | |
| B. | 蛋壳溶于食醋:CaCO3+CH3COOH═CH3COOCa+H2O+CO2↑ | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH--→CH2BrCOO-+H2O | |
| D. | 向氯乙烷水溶液中加入氢氧化钠溶液共热:CH3CH2Cl+NaOH→CH2=CH2+NaCl+H2O |
6.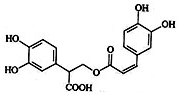 迷迭香酸是从蜂花属植物中提取得到的酸性物质.其结构如图.
迷迭香酸是从蜂花属植物中提取得到的酸性物质.其结构如图.
下列叙述正确的是( )
 迷迭香酸是从蜂花属植物中提取得到的酸性物质.其结构如图.
迷迭香酸是从蜂花属植物中提取得到的酸性物质.其结构如图. 下列叙述正确的是( )
| A. | 迷迭香酸属于芳香烃 | |
| B. | 1mol迷迭香酸最多能和9mol氢气发生加成反应 | |
| C. | 迷迭香酸可以发生加成反应、取代反应和酯化反应 | |
| D. | 迷迭香酸的化学式为C18H18O8 |
16.下列热化学方程式中△H代表燃烧热的是( )
| A. | CH4 ( g )+$\frac{3}{2}$O2( g )═2H2O ( l )+CO ( g )△H1 | |
| B. | S ( s )+$\frac{3}{2}$O2 ( g )═SO3 ( s )△H2 | |
| C. | C6H12O6 ( s )+6O2 ( g )═6CO2 (g)+6H2O ( l )△H3 | |
| D. | 2CO ( g )+O2( g )═2CO2 ( g )△H4 |
 (1)如图为金刚烧的空间结构(碳架)
(1)如图为金刚烧的空间结构(碳架)
 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.