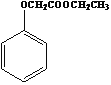
题目内容
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
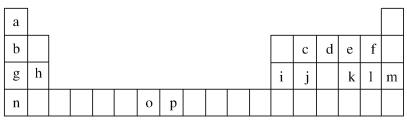
(1)元素p为26号元素,请写出其基态原子的电子排布式________________。
(2)d与a反应的产物的分子,空间构型为_________________。
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:________________________________________。
(4)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/ (kJ·mol-1) | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是___________________________________。
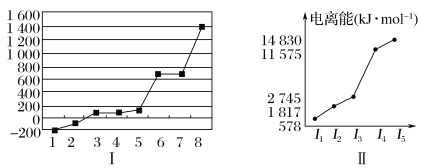
(5)第三周期8种元素按单质熔点高低的顺序如图Ⅰ所示,其中电负性最大的是________(填图中的序号)。
(6)表中所列的某主族元素的电离能情况如图Ⅱ所示,则该元素是________(填元素符号)。
【答案】1s22s22p63s23p63d64s2 三角锥形 电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量 Mn2+的3d轨道电子排布为半满状态,比较稳定 2 Al
【解析】
根据元素在周期表中的位置知,a到p分别是H、Li、C、N、O、F、Na、Mg、Al、Si、S、Cl、Ar、K、Mn、Fe元素;
(1)Fe原子核外电子数为26,根据能量最低原理书写核外电子排布式;
(2)d与a反应的产物为氨气,中心原子氮原子的价层电子对数判断氮原子的杂化方式,再确定空间构型;
(3)镁在空气中燃烧发出耀眼的白光,在反应过程中电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量,以此答题;
(4)由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态;
(5)第三周期8种元素,只有Si单质为原子晶体,熔点最大,分子晶体的熔点低,有磷、硫、氯气、氩气几种物质,但Cl的电负性最大;
(6)根据表中所列的某主族元素的电离能可知,该元素原子最外层电子数为3,据此答题。
根据元素在周期表中的位置知,a到p分别是H、Li、C、N、O、F、Na、Mg、Al、Si、S、Cl、Ar、K、Mn、Fe元素;
:(1)Fe原子核外电子数为26,根据能量最低原理可知,其核外电子排布式为:1s22s22p63s23p63d64s2;
(2)d与a反应的产物为氨气,中心原子氮原子形成三个电子对,有一个孤对电子,杂化方式为sp3,分子构型为三角锥形;
(3)镁在空气中燃烧发出耀眼的白光,在反应过程中电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量;
(4)由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少;
(5)第三周期8种元素,只有Si单质为原子晶体,熔点最大,与图中8对应;分子晶体的熔点低,有磷、硫、氯气、氩气几种物质,但Cl的电负性最大,与图中2对应;
(6)根据表中所列的某主族元素的电离能可知,该元素原子最外层电子数为3,所以该元素为Al元素。

【题目】某同学研究浓度对化学平衡的影响,下列说法正确的是
已知:Cr2O72-(aq)(橙色)+H2O(l) | |
步骤: | 现象: 待试管b中颜色不变后与试管a比较, 溶液颜色变浅。 滴加浓硫酸,试管c温度略有升高, 溶液颜色与试管a相比,变深。 |
A. 该反应是一个氧化还原反应
B. 待试管b中溶液颜色不变的目的是使Cr2O72-完全反应
C. 该实验不能证明减小生成物浓度,平衡正向移动
D. 试管c中的现象说明影响平衡的主要因素是温度
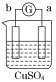
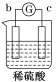
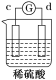
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小 b极质量增加 | 溶液中的H+向c极移动 | d极溶解 c极有气体产生 | 电流从a极流出 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>a
C.d>a>b>cD.a>b>d>c