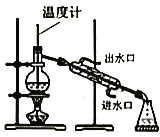
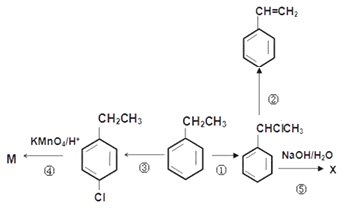
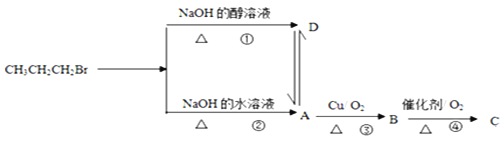
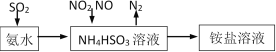题目内容
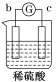
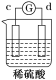
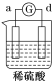
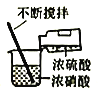
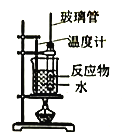
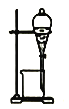
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小 b极质量增加 | 溶液中的H+向c极移动 | d极溶解 c极有气体产生 | 电流从a极流出 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>a
C.d>a>b>cD.a>b>d>c
【答案】C
【解析】
原电池中一般负极金属比正极金属活泼,可以根据电子流出、电流流入、质量减少、发生氧化反应、溶液中的阴离子流向等判断原电池的负极,据此分析作答。
装置1中a极质量减小,b极质量增加,可知a做负极,b做正极,a比b活泼;装置2中溶液中的H+向c极移动,则c为正极,b为负极,b比c活泼;装置3中d极溶解,c极有气体产生,说明d为负极,c做正极,d比c活泼;装置4中电流从a极流出,a为正极,d做负极,d比a活泼,综上金属的活泼性顺序为:d>a>b>c。
故选:C。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
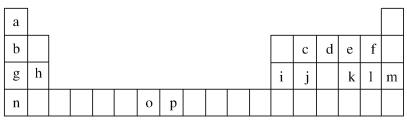
(1)元素p为26号元素,请写出其基态原子的电子排布式________________。
(2)d与a反应的产物的分子,空间构型为_________________。
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:________________________________________。
(4)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/ (kJ·mol-1) | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是___________________________________。
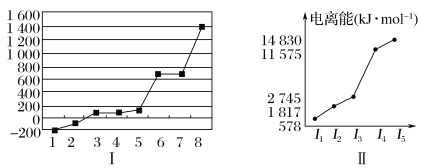
(5)第三周期8种元素按单质熔点高低的顺序如图Ⅰ所示,其中电负性最大的是________(填图中的序号)。
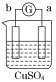
(6)表中所列的某主族元素的电离能情况如图Ⅱ所示,则该元素是________(填元素符号)。