题目内容
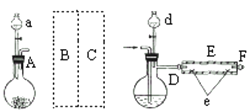
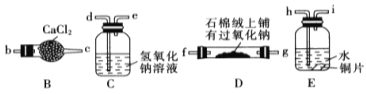
【题目】己知木炭在一定条件下与浓硝酸反应生成两种+4价的氧化物。为了探究一氧化氮(NO)能否与过氧化钠反应,以及反应后的产物中是否有亚硝酸钠(NaNO2),某小组同学设计了如图所示装置(夹持仪器和连接用的乳胶管已经省略)。为了完成该实验,按气流方向A→E→C→B→D→尾气处理装置(略)顺序连接以下装置。请回答相关问题:
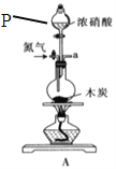
(1)仪器P的名称是 。
(2)写出浓硝酸与木炭反应的化学方程式 。
(3)检查气密性并装入药品后,要进行以下三项操作:a.点燃酒精灯,b.滴加浓硝酸,c.通入一段时间的氮气,则它们正确顺序是 (填字母编号)。反应开始时先通入氮气的主要目的是 。
(4)实验中装置C的作用是 。装置E中观察到的主要实验现象有 。
(5)某同学经查阅资料后发现亚硝酸是弱酸,性质不稳定,室温下易分解生成一氧化氮。装置D中充分反应后,设计实验证明D中是否有亚硝酸钠生成 。
【答案】(1)分液漏斗 (2)C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
(3)c b a 排除装置内空气,防止氧气将NO氧化
(4)除去NO中混有的CO2(或CO2和NO2)
铜片逐渐溶解,溶液变蓝,有无色气泡冒出(或红棕色气体变为无色气体)
(5)取装置D中固体少量于试管中,加入适量稀硫酸,若有气泡冒出且在溶液上方变成红棕色,证明D中有亚硝酸钠生成
【解析】
试题分析:(1)根据仪器的特征,仪器P的名称为分液漏斗。
(2)装置A中是浓硝酸和碳加热发生反应,反应生成二氧化氮和二氧化碳和水,反应的化学方程式为C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O。
CO2↑+4NO2↑+2H2O。
(3)探究一氧化氮(NO)能否与过氧化钠反应,则需要将NO2转化为NO,同时除去CO2和水蒸气,所以正确的连接顺序是c b a ;由于装置中含有空气,能氧化NO为NO2,所以先通入氮气的主要目的是排除装置内空气,防止氧气将NO氧化。
(4)混合气体中含有CO2,CO2能与过氧化钠反应,所以装置C的作用是除去NO中混有的CO2(或CO2和NO2);NO2溶于水生成NO和硝酸,硝酸氧化单质铜生成硝酸铜、一氧化氮和水,所以观察到的实验现象是铜片逐渐溶解,溶液变蓝,有无色气泡冒出。
(5)由于亚硝酸是弱酸,性质不稳定,室温下易分解成一氧化氮,所以检验D中是否有亚硝酸钠生成的实验方案是取装置D中固体少量于试管中,加入适量稀硫酸,若有气泡冒出且在溶液上方变成红棕色,证明D中有亚硝酸钠生成。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案