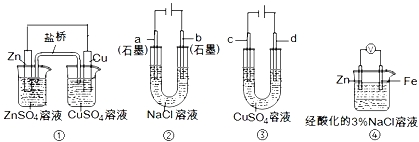
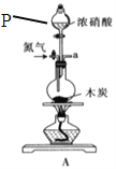
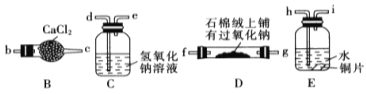
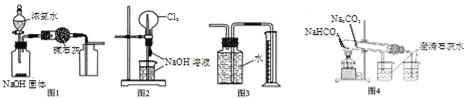题目内容
【题目】某温度下,反应2N2O5(g)═4NO2(g)+O2(g)开始时,c(N2O5)=0.040 8molL﹣1,经1min后,c(N2O5)=0.030 0molL﹣1.则该反应的反应速率为( )
A.v(N2O5)=1.80×10﹣3 molL﹣1min﹣1
B.v(N2O5)=1.08×10﹣2 molL﹣1min﹣1
C.v(NO2)=1.80×10﹣3 molL﹣1min﹣1
D.v(O2)=1.80×10﹣2 molL﹣1min﹣1
【答案】B
【解析】
试题分析:根据v=![]() 、化学反应速率之比等化学计量数之比进行计算
、化学反应速率之比等化学计量数之比进行计算
解:v(N2O5)=![]() =1.08×10﹣2molL﹣1min﹣1,化学反应速率之比等于化学方程式计量数之比,
=1.08×10﹣2molL﹣1min﹣1,化学反应速率之比等于化学方程式计量数之比,
v(N2O5):v(NO2)=1:2,故v(NO2)=2v(N2O5)=2×1.08×10﹣2mol=3.16×10﹣2molL﹣1s﹣1;
v(N2O5):v(O2)=2:1,故v(O2)=0.5v(N2O5)=0.5×1.08×10﹣2mol=5.4×10﹣3molL﹣1s﹣1;
故选B.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目