题目内容
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性
Ⅰ.实验室制备FeBr2
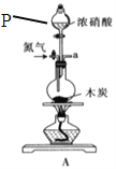
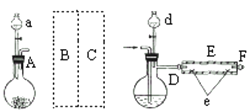
实验室用下图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管.e是两只耐高温的瓷皿,其中盛有细铁粉.
实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁
请回答:
(1)如何检查用塞子(插有导管和仪器)塞紧的D的气密性________.
(2)若在A中盛固体CaCO3,a中盛6mol/L盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为________,C为________.为防止污染空气,实验时应在F处连接盛________的尾气吸收装置
(3)反应过程中要不断通入CO2,其主要作用是①________,②________.
Ⅱ.探究FeBr2的还原性,
(1)实验需要90 mL 0.1 mol·L-1FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外还需的玻璃仪器是________。
(2)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
设计实验证明假设2是正确的_______________________________
(3)实验证明:还原性Fe2+>Br-请用一个离子方程式来证明:______________________________;
(4)若在40mL上述FeBr2溶液中通入3×10-3molCl2,则反应的离子方程式为:_____。
【答案】 关闭d的活塞,夹紧C~D之间的胶管,将下出口导管插入水中,然后将D用手捂热,若下导管出口有气泡冒出,松开手后水回升到导管中,则证明D装置不漏气 NaHCO3溶液的洗气瓶 浓H2SO4的洗气瓶 NaOH溶液 用CO2把反应器中空气赶尽 将Br2蒸气带入反应管中 100 mL容量瓶 向黄色溶液中加入少量KSCN溶液,若溶液变血红色,则证明假设2正确 2Fe2++Br2=2Fe3++2Br- 4Fe2++2Br-+3Cl2 = 4Fe3++ Br2+2Cl-
【解析】试题分析:Ⅰ.(1)由于装置D中含有进气口和分液漏斗,所以检验装置D的操作是:关闭d的活塞,夹紧C~D之间的胶管,将下出口导管插入水中,然后将D用手捂热,若下导管出口有气泡冒出,松开手后水回升到导管中,则证明D装置不漏气。
(2)浓盐酸易挥发,生成的CO2气体中含有水蒸气和氯化氢,因此要得到干燥纯净的水蒸气可以依次通过盛有饱和碳酸氢钠溶液和浓硫酸的洗气瓶;溴蒸汽有毒,为了防止污染空气,实验时应在F处连接盛氢氧化钠溶液的尾气吸收装置。
(3)由于装置含有空气,空气中的氧气能氧化金属铁,另外为了使溴蒸汽能与铁充分接触反应,依次CO2的主要作用是用CO2把反应器中空气赶尽,同时将Br2蒸气带入反应管中。
Ⅱ.(1)配制FeBr2溶液时需要天平、钥匙、烧杯、玻璃棒、100mL的容量瓶,胶头滴管,则除烧杯、量筒、胶头滴管外还需的玻璃仪器是100mL的容量瓶;
(2)由于铁离子能与KSCN溶液反应使溶液显红色,因此证明假设2成立的是向黄色溶液中加入少量KSCN溶液,若溶液变血红色,则证明假设2正确;
(3)由还原性Fe2+>Br-,则氯化亚铁溶液中加入1~2滴溴水发生氧化还原反应生成Fe3+,反应为的离子方程式Fe2++Br2=2Fe3++2Br-;
(3)溴化亚铁的物质的量是0.004mol,氯气是0.003ml,由于还原性Fe2+>Br-,二者以4:3反应,由电子守恒可知,亚铁离子全部被氧化,溴离子有0.002mol被氧化,因此反应的离子反应方程式为4Fe2++2Br-+3Cl2=4Fe3++Br2+2Cl-。

 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案