题目内容
【题目】A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其他产物已略去):
![]()
(1)若A、D的水溶液均呈酸性,且D为强酸.
①A、D分别为A: ,D: .(填写化学式,下同)
②写出B→C转化的化学方程式: .
③简述检验B物质的方法 .
④写出D的浓溶液和Cu在加热条件的化学方程式 .21*cnjy*com
(2)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使蓝色的湿润石蕊试纸变红.
①工业上合成A的化学方程式: .在实验室中则用加热固体混合物的方法制取气体A,其化学方程式为 .
②写出C→D的化学方程式,并用双线桥标出电子转移的方向和数目.
③写出A→B的化学方程式
④1.92g铜投入一定的D浓溶液中,铜完全溶解,共收集到672mL气体(标准状况).将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积为 mL.
【答案】(1)①H2S;H2SO4;
②2SO2+O2![]() 2SO3;
2SO3;
③将B通入到品红溶液中,溶液褪色,加热后,又恢复为红色;
④2H2SO4(浓)+Cu![]() CuSO4+2H2O+SO2↑;
CuSO4+2H2O+SO2↑;
(2)①N2+3H2![]() 2NH3;Ca(OH)2+2NH4Cl
2NH3;Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
② ;
;
③4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
④336
【解析】试题分析:(1)若A、D的水溶液均呈酸性,且D为强酸,S元素化合物符合转化关系,可推知A为H2S、B为SO2、C为SO3、D为H2SO4;
(2)若A的水溶液能使湿润的红色石蕊试纸变蓝,则A是NH3,D的稀溶液能使湿润的蓝色石蕊试纸变红,为酸,氨气被氧化生成NO,NO被氧气氧化生成NO2,所以B是NO、C是NO2、D是HNO3。
解:(1)①若A、D的水溶液均呈酸性,且D为强酸,S元素化合物符合转化关系,可推知,A为H2S、B为SO2、C为SO3、D为H2SO4,故答案为:H2S;H2SO4;
②B→C转化的化学方程式:2SO2+O2![]() 2SO3,
2SO3,
故答案为:2SO2+O2![]() 2SO3;
2SO3;
③简述检验SO2物质的方法:将B通入到品红溶液中,溶液褪色,加热后,又恢复为红色,
故答案为:将B通入到品红溶液中,溶液褪色,加热后,又恢复为红色;
④硫酸的浓溶液和Cu在加热条件的化学方程式:2H2SO4(浓)+Cu![]() CuSO4+2H2O+SO2↑,
CuSO4+2H2O+SO2↑,
故答案为:2H2SO4(浓)+Cu![]() CuSO4+2H2O+SO2↑;
CuSO4+2H2O+SO2↑;
(2)若A的水溶液能使湿润的红色石蕊试纸变蓝,则A是NH3,D的稀溶液能使湿润的蓝色石蕊试纸变红,为酸,氨气被氧化生成NO,NO被氧气氧化生成NO2,所以B是NO、C是NO2、D是HNO3.
①工业上合成氨气的化学方程式:N2+3H2![]() 2NH3.在实验室中则用氯化铵与氢氧化钙加热制取气体氨气,其化学方程式为:Ca(OH)2+2NH4Cl
2NH3.在实验室中则用氯化铵与氢氧化钙加热制取气体氨气,其化学方程式为:Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O,
CaCl2+2NH3↑+2H2O,
故答案为:N2+3H2![]() 2NH3;Ca(OH)2+2NH4Cl
2NH3;Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
②C→D的化学方程式,并用双线桥标出电子转移的方向和数目: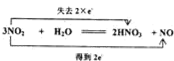 ,
,
故答案为: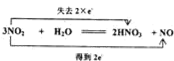 ;
;
③A→B的化学方程式:4NH3+5O2![]() 4NO+6H2O,
4NO+6H2O,
故答案为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
④Cu与浓硝酸反应生成硝酸铜与氮的氧化物,氮的氧化物与氧气、水反应又完全反应生成硝酸,纵观整个过程,Cu失去电子物质的量等于氧气获得电子物质的量,1.92gCu的物质的量为![]() =0.03mol,故需要氧气物质的量为
=0.03mol,故需要氧气物质的量为![]() =0.015mol,故需要氧气体积为0.015mol×22.4L/mol=0.336L,即为336mL,
=0.015mol,故需要氧气体积为0.015mol×22.4L/mol=0.336L,即为336mL,
故答案为:336.

 阅读快车系列答案
阅读快车系列答案