题目内容
【题目】溴乙烷是一种重要的有机化工原料,其沸点为38.4℃。实验室制备溴乙烷并进行溴乙烷的性质实验如下,试回答下列问题:制备溴乙烷的的一种方法是乙醇与氢溴酸反应,该反应的化学方程式为:CH3CH2OH+HBr![]() CH3CH2Br+H2O。
CH3CH2Br+H2O。
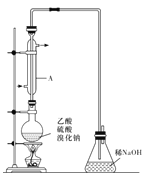
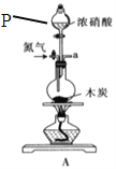
I.实际通常是用溴化钠与一定浓度的硫酸和乙醇反应。某课外小组欲在实验室制备溴乙烷的装置如图,实验操作步骤如下:
①检查装置的气密性;
②在圆底烧瓶中加入95%乙醇、80%硫酸,然后加入研细的溴化钠粉末和几粒碎瓷片;
③小心加热,使其充分反应。
请问答下列问题。
(1)装置A的作用是 。
(2)反应时若温度过高,则有SO2生成,同时观察到还有一种红棕色气体产生,该气体的分子式是 。
(3)反应结束后,得到的粗产品呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的 (填写正确选项的字母)。
a.稀氢氧化钠溶液 b.乙醇 c.四氯化碳
该实验操作中所需的主要玻璃仪器是 (填仪器名称)。
II.溴乙烷的性质实验
(4)为了检验溴乙烷中含有溴元素,不能直接向溴乙烷中滴加硝酸银溶液来检验,其原因是 。通常采用的方法是取少量溴乙烷,然后 (按实验的操作顺序选填下列序号)。
①加热 ②加入AgNO3溶液 ③加入稀HNO3酸化 ④加入NaOH溶液
(5)溴乙烷与NaOH乙醇溶液共热可产生乙烯气体。在进行该实验时,把生成的气体通过右图所示的装置。用该装置进行实验的目的是检验乙烯的生成,该图中右侧试管中的现象是______________;左侧试管中水的作用是___________________。

【答案】(1)冷凝回流(2)Br2 (3)a;分液漏斗;
(4)溴乙烷为非电解质,不能电离出Br-,不能与硝酸银溶液反应生成沉淀 ④①③②
(5)酸性高锰酸钾溶液褪色;除去乙醇等杂质干扰;
【解析】
试题分析:(1)实验时,长玻璃导管的作用是冷凝回流,可以获得要制取的有机物,所以装置A的作用是冷凝回流。
(2)浓硫酸具有氧化性,可以将还原性的溴离子氧化为溴单质,得到的红棕色气体为溴蒸气,浓硫酸自身被还原为二氧化硫,则该气体的分子式是Br2。
(3)溴单质溶解在有机物中显棕黄色,为了除去粗产品中的杂质溴单质,可以用氢氧化钠来与之发生反应,生成的溶液和溴乙烷互不相溶,答案为选a;实现溴乙烷和氯化钠、次氯酸钠水溶液的分离可以采用分液法,分液所需的主要玻璃仪器是分液漏斗。
(4)因为溴乙烷为非电解质,不能电离出Br-,不能与硝酸银溶液反应生成沉淀,所以为了检验溴乙烷中含有溴元素,不能直接向溴乙烷中滴加硝酸银溶液来检验;检验溴乙烷中含有溴元素一定要将之转化为溴离子,可以采用卤代烃的水解方法,即加入氢氧化钠即可,在溴离子可以和银离子反应生成淡黄色不溶于硝酸的沉淀溴化银来检验,可以加入硝酸酸化的硝酸银,答案为④①③②
(5)溴乙烷与NaOH乙醇溶液共热可产生乙烯气体,乙烯能使酸性高锰酸钾溶液褪色;因为乙醇易挥发,乙醇也能使酸性高猛酸钾溶液褪色,检验乙烯的生成需要排除乙醇的干扰,而乙醇与水互溶,所以水的作用是除去乙醇等杂质干扰。

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案