题目内容
某兴趣小组的学生根据活泼金属Mg与CO2发生反应,推测活泼金属钠也能与CO2发生反应,因此兴趣小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。已知:常温下,CO能使一些化合物中的金属离子还原
例如:PdCl2 + CO + H2O=Pd↓+ CO2 +2HCl 。反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。
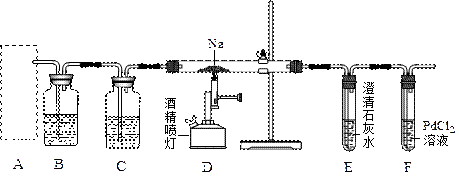
请回答下列问题:
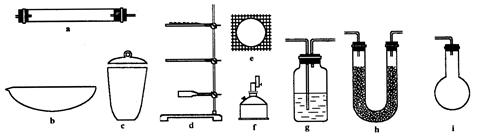
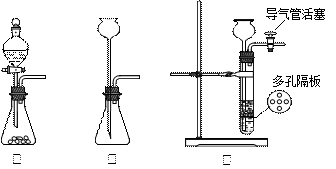
(1)通常实验室制取CO2气体的离子方程式是 ,为了使制气装置能“随开随用,随关随停”,上图A处应选用的装置是___ (填写 “Ⅰ”、“Ⅱ”或“Ⅲ”)。若要制取干燥、纯净的CO2气体,装置B中应盛放的试剂是 溶液,装置C中应盛放的试剂是________ 。
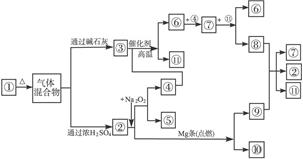
(2)观察实验装置图可知Na与CO2反应的条件是_____________。检查装置的气密性完好并装入药品后,在点燃酒精喷灯前,必须进行的操作是____________________。待装置______(填写字母)中出现 现象时,再点燃酒精喷灯,这步操作的目的是 。
(3)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请分析并回答问题:
①若装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
②若装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
(4)请用文字简要说明你判断②中D装置生成固体的成分是钠的正盐或酸式盐的理由。 。

例如:PdCl2 + CO + H2O=Pd↓+ CO2 +2HCl 。反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。


请回答下列问题:
(1)通常实验室制取CO2气体的离子方程式是 ,为了使制气装置能“随开随用,随关随停”,上图A处应选用的装置是___ (填写 “Ⅰ”、“Ⅱ”或“Ⅲ”)。若要制取干燥、纯净的CO2气体,装置B中应盛放的试剂是 溶液,装置C中应盛放的试剂是________ 。
(2)观察实验装置图可知Na与CO2反应的条件是_____________。检查装置的气密性完好并装入药品后,在点燃酒精喷灯前,必须进行的操作是____________________。待装置______(填写字母)中出现 现象时,再点燃酒精喷灯,这步操作的目的是 。
(3)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请分析并回答问题:
①若装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
②若装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
(4)请用文字简要说明你判断②中D装置生成固体的成分是钠的正盐或酸式盐的理由。 。
(1)CaCO3 + 2H+= Ca2+ + H2O + CO2↑(2分);
Ⅲ(1分); 饱和NaHCO3(1分); 浓H2SO4(1分)
(2)高温(或强热)(1分); 扭开装置Ⅲ中导气管活塞 (1分); E(1分)
澄清的石灰水变浑浊(1分); 排出该装置中的空气(1分)
(3)① 4Na + 3CO2
 2Na2CO3 + C (2分)
2Na2CO3 + C (2分)② 2Na + 2CO2
 Na2CO3 + CO (2分)
Na2CO3 + CO (2分)(4)生成正盐。因为根据质量守恒定律可知,反应物共有三种元素,没有氢元素,因
此不能生成酸式盐。(或:生成正盐。因为高温条件下碳酸氢钠不存在。)其它合理答
案均给分 (2分)
略

练习册系列答案
相关题目
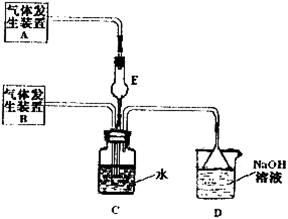
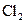 、
、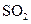 气体,现采用Na2SO3与70%的浓硫酸为原料制取SO2,采用MnO2和浓盐酸为原料制取C12。在此实验中,E仪器的作用是__________;发生装置B应选择以下三种装置中的___________(填序号)。
气体,现采用Na2SO3与70%的浓硫酸为原料制取SO2,采用MnO2和浓盐酸为原料制取C12。在此实验中,E仪器的作用是__________;发生装置B应选择以下三种装置中的___________(填序号)。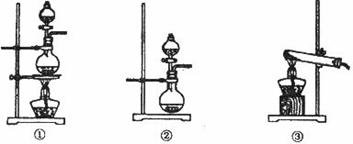
 入一种固体试剂,该试剂的名称为_________,B中能产生氨气和氧气混合气体的原
入一种固体试剂,该试剂的名称为_________,B中能产生氨气和氧气混合气体的原 因(结合化学方程式回答)_ __。
因(结合化学方程式回答)_ __。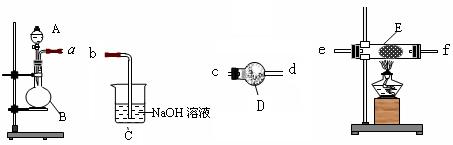
 4NO2(g);△H>0,下表为反应在某温度下的部分实验数据:
4NO2(g);△H>0,下表为反应在某温度下的部分实验数据: 和水,测它们的质量求得有机物中碳和氢的百分含量,现有某固态有机物在加热情况下鼓入足量的氧气使其完全燃烧,今有如下仪器。
和水,测它们的质量求得有机物中碳和氢的百分含量,现有某固态有机物在加热情况下鼓入足量的氧气使其完全燃烧,今有如下仪器。