题目内容
从废液FeCl3、FeCl2、CuCl2中回收Cu,同学们设计了如下方案:废液中加入过量的铁粉,过滤,向铁、铜混合物中加入足量的盐酸,过滤后得到铜。上述过程中发生的所有反应的离子方程式为: 这些反应所涉及的四种阳离子的氧化性顺序由大到小为
2Fe3+ + Fe = 3Fe2+, Fe + Cu2+ =" Cu" + Fe2+,
Fe + 2H+ = Fe2+ + H2↑; Fe3+ > Cu2+ > H+ > Fe2+
Fe + 2H+ = Fe2+ + H2↑; Fe3+ > Cu2+ > H+ > Fe2+
氯化铁具有氧化性能把单质铁氧化生成氯化亚铁。单质的金属性强于铜的,所以能把铜离子置换成铜。在金属活动顺序表中铜排在H的后面,和盐酸不反应。有关方程式为2Fe3+ + Fe = 3Fe2+, Fe + Cu2+ =" Cu" + Fe2+,Fe + 2H+ = Fe2+ + H2↑,所以根据氧化剂的氧化性大于氧化产物的可知Fe3+ > Cu2+ > H+ > Fe2+。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

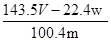 ×100%
×100% 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。