题目内容
(11分)研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)O、Si、N元素的电负性由大到小的顺序是_______________。
C60和金刚石都是碳的同素异形体,二者比较熔点高的是_______,原因是________________。
(2)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为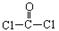 每个COCl2分子内含有 个δ键, 个π键。其中心原子采取 杂化轨道方式。
每个COCl2分子内含有 个δ键, 个π键。其中心原子采取 杂化轨道方式。
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g)反应过程中,断裂的化学键只有配位键,则形成的化学键类型是_______________。
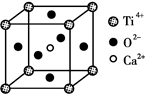
(3)CaTiO3晶体中(晶胞结构如图所示),Ti4+的氧配位数为________;晶体中,若将Ti4+置于立方体的体心,Ca2+置于立方体的顶点,则O2-处于立方体的______;
(1)O、Si、N元素的电负性由大到小的顺序是_______________。
C60和金刚石都是碳的同素异形体,二者比较熔点高的是_______,原因是________________。
(2)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为
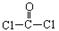 每个COCl2分子内含有 个δ键, 个π键。其中心原子采取 杂化轨道方式。
每个COCl2分子内含有 个δ键, 个π键。其中心原子采取 杂化轨道方式。②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g)反应过程中,断裂的化学键只有配位键,则形成的化学键类型是_______________。
(3)CaTiO3晶体中(晶胞结构如图所示),Ti4+的氧配位数为________;晶体中,若将Ti4+置于立方体的体心,Ca2+置于立方体的顶点,则O2-处于立方体的______;

⑴O>N> Si(1分) 金刚石(1分) C(60)是分子晶体而金刚石是原子晶体(2分)
⑵① 3、 1、 sp2 (各1分)②金属键(1分)
(3)12(2分) 棱心(1分)
⑵① 3、 1、 sp2 (各1分)②金属键(1分)
(3)12(2分) 棱心(1分)
(1)电负性:是元素的原子在化合物中吸引电子能力的标度;
同周期,从左到右,元素的电负性递增:O>N>C;
同主族,自上而下,元素的电负性减: C>Si;故电负性:O>N> Si;
(2) ①在碳、氯及碳、氧间各形成1个δ键;则碳、氧间另一共价键只能“肩并肩”形成π键;
故中心原子采取sp2杂化;
②在产物金属铁内存在金属键,故形成的化学键类型是金属键;
(3)如图:因为Ti4+在顶点上,而O2-在面心上,则在一个晶胞中Ti4+的氧配位数为3;会有8个晶胞公用1个Ti4+,则这8个晶胞中Ti4+的氧配位数为3×8=24;但在面心上的O2-会为两个面公用,故实际上:Ti4+的氧配位数为24/2=12
同周期,从左到右,元素的电负性递增:O>N>C;
同主族,自上而下,元素的电负性减: C>Si;故电负性:O>N> Si;
(2) ①在碳、氯及碳、氧间各形成1个δ键;则碳、氧间另一共价键只能“肩并肩”形成π键;
故中心原子采取sp2杂化;
②在产物金属铁内存在金属键,故形成的化学键类型是金属键;
(3)如图:因为Ti4+在顶点上,而O2-在面心上,则在一个晶胞中Ti4+的氧配位数为3;会有8个晶胞公用1个Ti4+,则这8个晶胞中Ti4+的氧配位数为3×8=24;但在面心上的O2-会为两个面公用,故实际上:Ti4+的氧配位数为24/2=12

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目




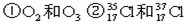 ③H2O和 D2O
③H2O和 D2O