题目内容
(6分)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质);


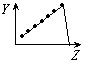
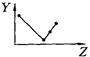
A B C D
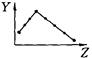
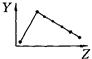


E F G H
把与下面的元素有关性质相符的曲线的标号填入相应括号中:
(1)ⅡA族元素的价电子数( ) (2)ⅦA族元素氢化物的沸点( )[学_
(3)第三周期元素单质的熔点( ) (4)第三周期元素的最高正化合价( )
(5)IA族元素单质熔点( ) (6)F-、Na+、Mg2+、Al3+四种离子的离子半径( )




A B C D




E F G H
把与下面的元素有关性质相符的曲线的标号填入相应括号中:
(1)ⅡA族元素的价电子数( ) (2)ⅦA族元素氢化物的沸点( )[学_
(3)第三周期元素单质的熔点( ) (4)第三周期元素的最高正化合价( )
(5)IA族元素单质熔点( ) (6)F-、Na+、Mg2+、Al3+四种离子的离子半径( )
B; D; E; C; F ;A
(1)第ⅡA族元素的价电子数都是2个,所以答案选B。
(2)由于氟化氢分子间存在氢键,所以氟化氢的沸点是同族中最高的,所以答案选D。
(3)第三周期元素金属单质的熔点逐渐升高,而非金属元素单质的熔点逐渐降低,所以答案选E。
(4)第三周期元素的最高正化合价自左向右逐渐增大,答案选C。
(5)IA族元素单质熔点自上而下逐渐降低,其中氢气最低,所以答案选F。
(6)核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小。所以F-、Na+、Mg2+、Al3+四种离子的离子半径逐渐降低,答案选A。
(2)由于氟化氢分子间存在氢键,所以氟化氢的沸点是同族中最高的,所以答案选D。
(3)第三周期元素金属单质的熔点逐渐升高,而非金属元素单质的熔点逐渐降低,所以答案选E。
(4)第三周期元素的最高正化合价自左向右逐渐增大,答案选C。
(5)IA族元素单质熔点自上而下逐渐降低,其中氢气最低,所以答案选F。
(6)核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小。所以F-、Na+、Mg2+、Al3+四种离子的离子半径逐渐降低,答案选A。

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目

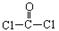 每个COCl2分子内含有 个δ键, 个π键。其中心原子采取 杂化轨道方式。
每个COCl2分子内含有 个δ键, 个π键。其中心原子采取 杂化轨道方式。