题目内容
【题目】明矾石经处理后得到明矾( KAl(SO4)2·12H2O)。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
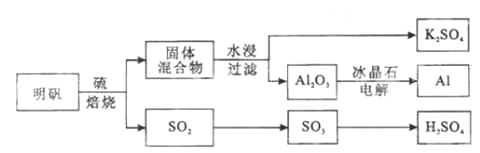
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是__________________。
(2)从水浸后的滤液中得到K2SO4晶体的方法是_____________________。
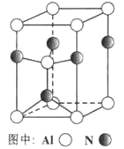
(3)A12O3在一定条件下可制得AIN,其晶体结构如右图所示,该晶体中Al的配位数是____。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是_____________________________。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g) +O2(g)![]() 2SO3(g) △H1= 一197 kJ/mol;
2SO3(g) △H1= 一197 kJ/mol;
2H2O (g)=2H2O(1) △H2=一44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=一545 kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是__________________________。
焙烧948t明矾(M=474 g/mol ),若SO2的利用率为96%,可生产质量分数为98%的硫酸________t。
【答案】S 蒸发结晶 4 Al+3NiO(OH)+NaOH+H2O=3Ni(OH)2+NaAlO2 SO3(g)+H2O(l)=H2SO4(l)△H=-152kJ·mol-1 432
【解析】
(1)4KAl(SO4)212H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O反应硫单质中硫元素化合价升高为+4价。硫酸根离子中硫元素化合价从+6价变化为+4价,故还原剂是硫单质,而氧化剂是6mol的硫酸根离子,即3mol的4KAl(SO4)212H2O,故答案为:S;
(2)从溶液中得到固体硫酸钾,可以才用蒸发结晶的方法,故答案:蒸发结晶;
(3)由图可知一个铝与4个氮原子成键,所以晶体中Al的杂化轨道方式为sp3,依据晶体晶胞结构分析,结合配位数含义可知,每个氮原子和四个铝原子相连,所以氮原子的配位数为4,故答案为:4;
(4)①以Al和NiO(OH)为电极,铝做原电池 负极失电子发生氧化反应,电极反应式为:Al-3e-+4OH-=AlO2-+2H2O;正极NiO(OH)得到电子发生还原反应,所以阳极反应为:Ni(OH)2-e-+OH-=NiO(OH)+H2O,故答案为:Al+3NiO(OH)+NaOH+H2O=3Ni(OH)2+NaAlO2;
(5)2SO2(g)+O2(g)2SO3(g)△H1=-197kJ/mol; ①
2H2O(g)=2H2O(1)△H2=-44kJ/mol; ②
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=-545kJ/mol. ③
依据盖斯定律③-①-②得到:2SO3(g)+2H2O(l)=2H2SO4(l)△H=-304KJ/mol,
即反应的热化学方程式为:SO3(g)+H2O(l)=H2SO4(l)△H=-152KJ/mol;
948 t明矾生成SO2物质的量为4500mol 故生成硫酸的质量m=4500×0.96×98÷0.98=432000Kg=432t.
故答案为:SO3(g)+H2O(l)=H2SO4(l)△H=-152kJ/mol;432.



