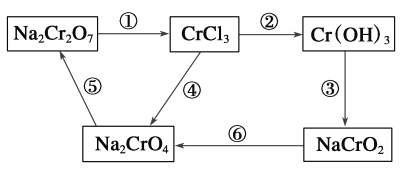
题目内容
【题目】(1)同温同压下,同体积的SO2与SO3质量之比为________,氧原子个数之比为________。
(2)在标准状况下,14g某气体的体积为11.2L,则该气体的相对分子质量是______________。
(3)在溶液中0.2 mol MnO4- 恰好能使0.5 mol SO32-离子完全氧化为SO42-,则Mn元素被还原后的化合价是________(填选项)。
A. +2 B. +3 C. +4 D. +5
【答案】4:5 2:3 28 A
【解析】
(1)根据PV=nRT及分子结构进行计算;
(2)利用公式M=![]() 及相对分子质量数值上等于摩尔质量,求解;
及相对分子质量数值上等于摩尔质量,求解;
(3)根据氧化还原反应中,化合价升降的总数相等,计算。
(1)同温同压下,同体积的SO2与SO3的物质的量相同,则物质的质量之比等于摩尔质量之比,即64:80=4:5;SO2与SO3中的O原子个数分别为分子个数的2、3倍,则氧原子个数之比为2:3;
(2)在标准状况下,11.2L的某气体的物质的量为0.5mol,M=![]() =
=![]() g/mol=28g/mol,相对分子质量数值上等于摩尔质量,分子量为28;
g/mol=28g/mol,相对分子质量数值上等于摩尔质量,分子量为28;
(3)根据氧化还原反应中,化合价升降的总数相等,即S化合价由+4变为+6,升高总数为2×0.5=1,Mn化合价降低总数=(+7-a)×0.2=1,则a=+2,答案为A。

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目