题目内容
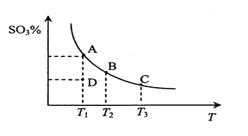
【题目】溴、碘主要存在于海水中,有“海洋元素”的美称。海水中的碘主要富集在海带中,我国海带产量居世界第一位,除供食用外,大量用于制碘。提取碘的途径如下图所示,下列有关叙述正确的是
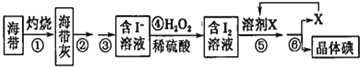
A. 此装置进行操作①
此装置进行操作①
B.②③操作中所用到的玻璃仪器有:玻璃棒、烧杯、分液漏斗
C.④中当1molH2O2氧化I-时,转移电子数为2NA
D.溶剂X可选用酒精或苯
【答案】C
【解析】
由流程可知,海带灼烧后,溶解、过滤得到含碘离子的溶液,加过氧化氢发生H2O2+2H++2I-═I2+2H2O,得到含碘的溶液,溶剂X为苯或四氯化碳等,X作萃取剂,得到含碘的有机溶液,最后蒸馏分离X与晶体碘,以此来解答。
A.灼烧选坩埚,不能选蒸发装置,故A错误;
B.溶解、过滤需要玻璃棒、烧杯、漏斗,不用分液漏斗,故B错误;
C.由H2O2+2H++2I═I2+2H2O可知,④中当1molH2O2氧化I时生成1mol碘单质,碘元素由-1价变为0价,转移2mol电子,转移电子数为2NA,故C正确;
D.X不能为酒精,酒精与水互溶,无法分液萃取提纯碘,故D错误;
答案选C。

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案【题目】高锰酸钾是常用的氧化剂。某化学小组在实验室以软锰矿(主要成分是MnO2)为原料制备KMnO4,下图是实验室制备高锰酸钾的操作流程。

已知:
温度 | 溶解度/g | ||
K2CO3 | KHCO3 | KMnO4 | |
20℃ | 111 | 33.7 | 6.38 |
请回答:
(1) 反应①的化学方程式为______________________________________,加热软锰矿、KClO3和KOH固体,除三脚架、玻璃棒、泥三角和铁坩埚外,还用到的仪器有___,不采用瓷坩埚而选用铁坩埚的理由是______________
(2) 反应②中氧化产物与还原产物的物质的量之比为___________________;上述流程中可以循环利用的物质是__________________________。
(3) 实验时,从滤液中得到KMnO4晶体的实验操作a为___________________,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低其原因是________。