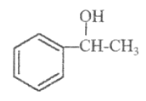
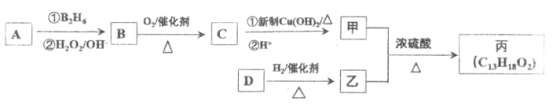
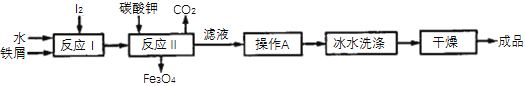
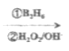题目内容
【题目】在铜-锌-稀硫酸构成的原电池中,当导线中有1mol电子通过时,下列说法正确的是
①锌片溶解了32.5g ②溶液中![]() 向铜片电极移动 ③正极上发生氧化反应产生了H2 ④铜片上逸出0.5molH2
向铜片电极移动 ③正极上发生氧化反应产生了H2 ④铜片上逸出0.5molH2
A.①③B.①④C.②③D.②④
【答案】B
【解析】
铜-锌-稀硫酸构成的原电池中,Zn作负极,电极反应为Zn-2e- =Zn2+;Cu作正极,电极反应为2H++2e-=H2↑。
①导线中有1mol电子通过,锌片溶解0.5mol,质量为32.5g,①正确;
②在原电池中,阴离子向负极移动,所以溶液中![]() 向锌电极移动,②不正确;
向锌电极移动,②不正确;
③原电池正极上得电子,发生还原反应,产生了H2,③不正确;
④导线中有1mol电子通过,铜片上逸出0.5molH2,④正确;
综合以上分析,只有①④正确,故选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】无机化合物可根据其组成和性质进行分类。
(1)如图所示的物质分类方法的名称是______________。
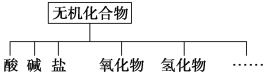
(2)
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①HCl ②______ | ③________ ④Ba(OH)2 | ⑤Na2CO3 ⑥_______ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在上表中②③⑥后面。
(3)写出⑦转化为⑤的化学方程式_______。