题目内容
【题目】现有A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大。A能分别与B、C、D三种元素形成电子数相同的分子,且B的最外层电子数是次外层电子数的2倍。E的阳离子、D的阴离子均与氖原子的电子层结构相同,且E的单质与D的单质反应能生成E2D和E2D2两种化合物。F所在主族序数与所在周期序数之差为4。(答题时,请用具体的化学用语表示)
(1)元素B在周期表中的位置__________周期________族;C元素的原子结构示意图_________________。
(2)写出由E、F两种元素形成的离子化合物的电子式________________,C2A4的结构式为:_______________,用电子式表示E2D的形成过程:_____________________。
(3)C、D、E形成的简单离子的半径由大到小的顺序为:_____________________。(用离子符号表示)
(4)E的最高价氧化物对应的水化物与F的最高价氧化物对应的水化物之间发生的化学反应方程式为:______________________________________________________________。
(5)向KI溶液中通入适量的F单质后,再滴加一定量的CCl4,振荡静置后的现象为_____________________________________,继续通入F单质并充分振荡,混合溶液逐渐褪为无色,若1mol还原剂转移10NA电子,上述反应的化学方程式为:___________________。
【答案】二 ⅣA ![]()
![]()
![]()
![]() N3->O2->Na+ NaOH+HClO4=NaClO4+H2O 溶液分层下层为紫色 5Cl2+I2+6H2O=10HCl+2HIO3
N3->O2->Na+ NaOH+HClO4=NaClO4+H2O 溶液分层下层为紫色 5Cl2+I2+6H2O=10HCl+2HIO3
【解析】
A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大,B的最外层电子数是次外层电子数的2倍,则B为C元素;E的阳离子、D的阴离子均与氖原子的电子层结构相同,且E的单质与D的单质反应能生成E2D和E2D2两种化合物,则可以确定E为Na元素,D为O元素;A能分别与B、C、D三种元素形成电子数相同的分子,可推断A为H元素,C为N元素;由于F原子序数在以上六种元素中最大,且E为Na元素,则F为第三周期元素,F所在主族序数与所在周期序数之差为4,则F为第三周期第ⅦA族的Cl元素,据此分析结合元素性质解答。
根据分析,A、B、C、D、E、F分别为H、C、N、O、Na、Cl;
(1) B为C元素,在周期表中的位置第二周期第ⅣA族;C为N元素,N原子结构示意图为![]() ;
;
(2) E为Na元素,F为Cl元素,由E、F两种元素形成的离子化合物为NaCl,NaCl的电子式为![]() ;A为H元素,C为N元素,C2A4为N2H4,结构式为:
;A为H元素,C为N元素,C2A4为N2H4,结构式为:![]() ;D为O元素,E为Na元素,E2D为Na2O,用电子式表示Na2O的形成过程为:
;D为O元素,E为Na元素,E2D为Na2O,用电子式表示Na2O的形成过程为:![]() ;
;
(3) C为N元素,D为O元素,E为Na元素,C、D、E形成的简单离子具有相同的电子层结构,电子层结构相同的微粒,核电荷数越大,半径越小,则离子半径由大到小的顺序为:N3->O2->Na+;
(4) E为Na元素,最高价氧化物对应的水化物为氢氧化钠,F为Cl元素,最高价氧化物对应的水化物高氯酸,二者发生酸碱中和反应,化学反应方程式为:NaOH+HClO4=NaClO4+H2O;
(5)F为Cl元素,其单质为氯气,向KI溶液中通入适量的氯气后,氯气与碘化钾反应生成碘单质和氯化钠,再滴加一定量的CCl4,振荡静置后,由于碘单质在四氯化碳中的溶解度远大于其在水中的溶解度,四氯化碳将生成的碘萃取到四氯化碳中,四氯化碳密度比水大,在下层,则现象为溶液分层,下层为紫色;继续通入氯气并充分振荡,混合溶液逐渐褪为无色,氯气和碘单质发生氧化还原反应,氯气的氧化性大于碘单质,氯气作氧化剂,碘单质作还原剂,若1molI2完全反应转移10NA电子,即一个碘原子失去5个电子,碘元素由0价变为+5价,Cl元素的化合价应降低,得到电子只能变为氯离子,则由此推断,氯气和碘单质在溶液中反应生成HCl和HIO3,发生反应的化学方程式为:5Cl2+I2+6H2O=10HCl+2HIO3。

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案【题目】无机化合物可根据其组成和性质进行分类。
(1)如图所示的物质分类方法的名称是______________。
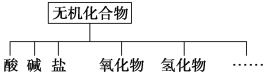
(2)
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①HCl ②______ | ③________ ④Ba(OH)2 | ⑤Na2CO3 ⑥_______ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在上表中②③⑥后面。
(3)写出⑦转化为⑤的化学方程式_______。