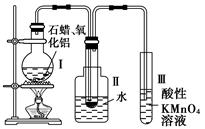
题目内容
白铁皮(镀锌铁皮)常用于制造屋面、卷管和各种容器,利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程如下: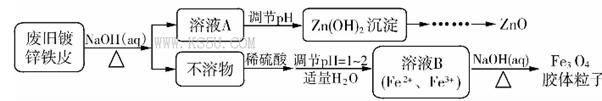
已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用是____________。
a.去除油污 b.溶解镀锌层 c.去除铁锈 d.钝化
(2)为获得Fe3O4胶体粒子,溶液B中必须含有一定量的Fe2+,可利用________检验其是否存在。
a.NaOH溶液 b.KSCN溶液 c.溶液KMnO4 d.氯水
(3)由溶液B制备Fe3O4胶体粒子的过程中,必须持续通入N2以保证产品的纯度,其原因是_____________ .
(4)在工业上常用水热法制造Fe3O4胶体粒子,有利于提高其纯度和磁性能,主要反应过程为:Fe2++S2O32-+O2+OH- Fe3O4(胶体)+S4O62-+H2O
Fe3O4(胶体)+S4O62-+H2O
①反应过程中起还原剂作用的微粒是________________;
②若反应过程中产生的Fe3O4(胶体)与S4O62-均为1mol,则参加反应的氧气在标准状况下的体积为____________L。
(1)ab (2)c (3)N2气氛下,防止Fe2+被氧化 (4)①Fe2+、S2O32- ②22.4
解析试题分析:(1)根据信息“Zn及化合物的性质与Al及化合物的性质相似”知,Zn也能和氢氧化钠溶液反应,氢氧化钠溶液起到溶解镀锌层和去除油污作用,选ab;
(2)溶液B中含有Fe3+和Fe2+,要检验其中的Fe2+要利用其还原性,能使溶液KMnO4溶液褪色,选c;
(3)Fe2+具有较强的还原性,易被氧化,持续通入N2,防止Fe2+被氧化;
(4)①反应过程中铁元素的化合价由Fe2+中的+2价升高到Fe3O4中的+3价,硫元素的化合价由S2O32-中的+2价升高到S4O62-中的+2.5价,Fe2+和S2O32-被氧化作还原剂;②反应过程中铁元素的化合价由Fe2+中的+2价升高到Fe3O4中的+3价,硫元素的化合价由S2O32-中的+2价升高到S4O62-中的+2.5价,产生的Fe3O4(胶体)与S4O62-均为1mol,失去的电子共4 mol,根据得失电子守恒知,参加反应的O2为1mol,标准状况下的体积为22.4L。
考点:以“废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO”为载体,考查化学实验基本操作,涉及溶液配制仪器的选择、Fe2+的检验及氧化还原反应相关知识。

以下进行性质比较的实验设计,不合理的是
| A.比较Cu、Fe2+的还原性:Cu加入FeCl3溶液中 |
| B.比较氯、溴非金属性:氯气通入溴化钠溶液中 |
| C.比较镁、铝金属性:镁、铝(除氧化膜)分别放入4mol·L¯1NaOH溶液中 |
| D.比较高锰酸钾、氯气的氧化性:高锰酸钾中加入浓盐酸 |
下列实验方案不可行或结论不正确的是
| A.用润湿的pH试纸测定饱和Na2CO3溶液pH |
B.通过观察图中导管水柱的变化,验证铁钉生锈的原因主要是吸氧腐蚀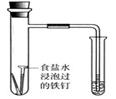 |
| C.向Mg(OH)2悬浊液中滴加FeCl3溶液,出现红褐色沉淀,说明溶解度:Fe(OH)3<Mg(OH)2 |
| D.向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉,通过完全反应后收集到的H2体积比较两种酸的电离程度:醋酸<盐酸 |
下列实验能达到目的的是
| A.用锌与稀硝酸制备H2 |
| B.用酸性KMnO4溶液鉴别1-戊烯和甲苯 |
| C.用丁达尔效应鉴别鸡蛋白溶液和食盐水 |
| D.用水来除去NO2中少量的NO |
(1)小明在做“研究温度对反应速率的影响”实验时,他取了两只试管,均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于凉水中,记录溶液褪色所需的时间。
①需要用 来酸化KMnO4溶液,褪色所需时间tA tB(填“>”、“=”或“<”).
②写出该反应的离子方程式 .
(2)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250mL溶液:准确称量5.0g乙二酸样品,配成250mL溶液。
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000mol?L﹣1KMnO4溶液装入
(填“酸式”或“碱式”)滴定管,进行滴定操作。在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色。将锥形瓶摇动一段时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了。请解释原因: 。当 ,证明达到滴定终点.
③计算:再重复上述操作2次,记录实验数据如下.
| 序号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 0.00 | 21.10 |
④误差分析:下列操作会导致测定结果偏高的是 。
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.不小心将少量酸性KMnO4溶液滴在锥形瓶外
E.观察读数时,滴定前仰视,滴定后俯视.
下列根据实验操作和现象所得出的结论正确的是( )。
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向淀粉溶液中加稀硫酸,加热片刻,滴加银氨溶液,再水浴加热 | 无银镜生成 | 淀粉未发生水解 |
| B | 向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 | 有白色沉淀生成 | 溶液X中一定含有CO或HCO |
| C | 将一片铝箔置于酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al |
| D | 取久置的绿矾(FeSO4·7H2O)溶于水,加入KSCN溶液 | 溶液变为血红色 | 绿矾部分或全部被氧化 |