题目内容
20.反应2SO2(g)+O2(g)?2SO3(g)经一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04mol/(L•s),则这段时间为( )| A. | 0.1 s | B. | 2.5 s | C. | 10 s | D. | 5 s |
分析 根据速率之比等于化学计量数之比计算v(SO3),再利用△t=$\frac{△c}{v}$计算.
解答 解:用O2表示的反应速率为0.04mol•L-1•s-1,
则v(SO3)=2v(O2)=2×0.04mol•L-1•s-1=0.08mol•L-1•s-1,
故反应时间=$\frac{0.4mol/L}{0.08mol/L•s}$=5s,
故选D.
点评 本题考查化学反应速率的有关计算,比较基础,注意对公式的理解与灵活运用,题目较简单.

练习册系列答案
相关题目
6.由丙烷、乙烯、乙炔组成的混合气体,完全燃烧后生成CO2和H2O的物质的量相同,原混合气体中三种烃的体积之比不可能是( )
| A. | 1:2:1 | B. | 3:2:3 | C. | 2:5:2 | D. | 1:2:3 |
11.下列分子式只能表示一种物质的是( )
| A. | C3H7Cl | B. | CH2Cl2 | C. | C4H10 | D. | C2H6O |
8.下列实验装置能够达到目的是( )
| A. | 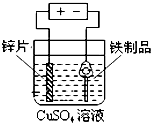 铁制品表面镀锌 | B. | 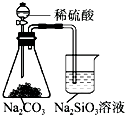 验证碳酸酸性强于硅酸 | ||
| C. | 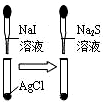 说明溶解性AgCl<AgI<Ag2S | D. |  浸在冷水中的玻璃球颜色较深 |
15.下列实验“操作和现象”与“结论”对应关系正确的是( )
| 操作和现象 | 结论 | |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | HNO3分解生成了NO2 |
| B | 向苯酚的浓溶液中加入溴水,无沉淀产生 | 苯酚与溴水不反应 |
| C | 向无水乙醇中加入浓H2SO4,加热至170℃,产生的气体通入酸性KMnO4溶液,紫红色褪去 | 使溶液褪色的气体只是乙烯 |
| D | 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 | 析出了NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
5.下列有机化合物分子中的所有碳原子不可能处于同一平面的是.
| A. | 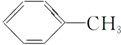 | B. | HC≡C-CH3 | ||
| C. | 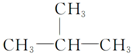 | D. |  |
9.分子式为C5H12O的醇与和它相对分子质量相等的一元羧酸进行酯化反应,生成的酯共有(不考虑立体异构)( )
| A. | 8种 | B. | 16种 | C. | 32种 | D. | 64种 |
10.下列对“氢气和氧气反应生成水是放热反应”的理解合理的是( )
| A. | 反应的氢气和氧气的总能量高于反应生成的水的总能量 | |
| B. | 2 mol水的总能量高于2 mol氢气和1 mol氧气的总能量 | |
| C. | 断裂2 molH-H键和断裂1 molO═O键吸收的总能量低于形成4 molH-O键放出的总能量 | |
| D. | 断裂4 molH-O键吸收的总能量高于形成2 molH-H键和形成1 molO═O键放出的总能量 |

 .
.