题目内容
【题目】硫酸亚铁铵![]() 又称莫尔盐,是浅绿色晶体。用硫铁矿
又称莫尔盐,是浅绿色晶体。用硫铁矿![]() 主要含
主要含![]() 、
、![]() 等
等![]() 制备莫尔盐的流程如下:
制备莫尔盐的流程如下:
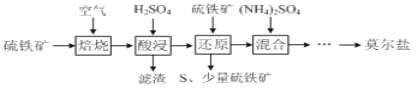
已知:“还原”时,![]() 与
与![]() 不反应,
不反应,![]() 通过反应Ⅰ、Ⅱ被还原,反应Ⅰ如下:
通过反应Ⅰ、Ⅱ被还原,反应Ⅰ如下:![]()
![]() 写出“还原”时
写出“还原”时![]() 与
与![]() 发生还原反应Ⅱ的离子方程式:__________。
发生还原反应Ⅱ的离子方程式:__________。
实验室检验“还原”已完全的方法是__________。
![]() “还原”前后溶液中部分离子的浓度见下表
“还原”前后溶液中部分离子的浓度见下表![]() 溶液体积变化忽略不计
溶液体积变化忽略不计![]() ,请计算反应Ⅰ、Ⅱ中被还原的Fe
,请计算反应Ⅰ、Ⅱ中被还原的Fe![]() 的物质的量之比__________。
的物质的量之比__________。
离子 | 离子浓度 | |
还原前 | 还原后 | |
|
|
|
|
|
|
![]() 称取
称取![]() 新制莫尔盐,溶于水配成250mL溶液。取
新制莫尔盐,溶于水配成250mL溶液。取![]() 该溶液加入足量的
该溶液加入足量的![]() 溶液,得到白色沉淀
溶液,得到白色沉淀![]() ;另取
;另取![]() 该溶液用
该溶液用![]() 酸性溶液滴定,当
酸性溶液滴定,当![]() 恰好完全被还原为
恰好完全被还原为![]() 时,消耗溶液的体积为
时,消耗溶液的体积为![]() 。试确定莫尔盐的化学式
。试确定莫尔盐的化学式![]() 请写出计算过程)________________。
请写出计算过程)________________。
【答案】![]()
![]() 取少量酸浸后的溶液,向其中滴加数滴KSCN溶液,如果溶液变红则“还原”未完全,反之,已完全
取少量酸浸后的溶液,向其中滴加数滴KSCN溶液,如果溶液变红则“还原”未完全,反之,已完全 ![]()
![]() 或
或 ![]() 。
。
【解析】
![]() 酸浸后的溶液中含有
酸浸后的溶液中含有![]() ,与硫铁矿反应,生成
,与硫铁矿反应,生成![]() ,硫元素被氧化为硫单质;如果
,硫元素被氧化为硫单质;如果![]() 还原完全,则加入KSCN,溶液不变红,如果溶液变红则“还原”未完全;
还原完全,则加入KSCN,溶液不变红,如果溶液变红则“还原”未完全;
![]() 则Ⅰ、Ⅱ中被还原的
则Ⅰ、Ⅱ中被还原的![]() 的物质的量之比
的物质的量之比![]() :
:![]() ;
;
![]() 依据电子转移守恒、电荷守恒、质量守恒进行计算。
依据电子转移守恒、电荷守恒、质量守恒进行计算。
![]() 酸浸后的溶液中含有
酸浸后的溶液中含有![]() ,与硫铁矿反应,生成
,与硫铁矿反应,生成![]() ,硫元素被氧化为硫单质,则化学方程式为:
,硫元素被氧化为硫单质,则化学方程式为:![]()
![]() ,如果
,如果![]() 还原完全,则加入KSCN,溶液不变红,则检验方法为:取少量酸浸后的溶液,向其中滴加数滴KSCN溶液,如果溶液变红则“还原”未完全,反之,已完全,故答案为:
还原完全,则加入KSCN,溶液不变红,则检验方法为:取少量酸浸后的溶液,向其中滴加数滴KSCN溶液,如果溶液变红则“还原”未完全,反之,已完全,故答案为:![]()
![]() ;取少量酸浸后的溶液,向其中滴加数滴KSCN溶液,如果溶液变红则“还原”未完全,反之,已完全;
;取少量酸浸后的溶液,向其中滴加数滴KSCN溶液,如果溶液变红则“还原”未完全,反之,已完全;
![]() 还原前后硫酸根浓度变化量
还原前后硫酸根浓度变化量![]() ,由反应I的方程式可知被还原的
,由反应I的方程式可知被还原的![]() 的物质的量浓度为
的物质的量浓度为![]() ,同时生成
,同时生成![]() ,从表中可知亚铁离子浓度变化为
,从表中可知亚铁离子浓度变化为![]() ,则II中被还原的
,则II中被还原的![]() 的物质的量浓度为
的物质的量浓度为![]() ,则Ⅰ、Ⅱ中被还原的
,则Ⅰ、Ⅱ中被还原的![]() 的物质的量之比
的物质的量之比![]() :
:![]() ,故答案为:
,故答案为:![]() ;
;
![]() 原样品中n(SO42-)=
原样品中n(SO42-)=![]() =0.06mol,n(MnO4-)=0.0200mol/L×0.03L=0.0006mol,由得失电子守恒可知:n(Fe2+)=5n(MnO4-)=0.003mol,原样品中n(Fe2+)=0.03 mol,由电荷守恒可知:原样品中n(NH4+)=0.06mol,由质量守恒得:n(H2O)=0.18mol,得出化学式为:
=0.06mol,n(MnO4-)=0.0200mol/L×0.03L=0.0006mol,由得失电子守恒可知:n(Fe2+)=5n(MnO4-)=0.003mol,原样品中n(Fe2+)=0.03 mol,由电荷守恒可知:原样品中n(NH4+)=0.06mol,由质量守恒得:n(H2O)=0.18mol,得出化学式为: ![]() 或
或 ![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】含+6价铬的废水毒性强,对环境污染严重,工业上常利用化学原理把+6价铬转化为不溶性Cr(OH)3除去。
Ⅰ、SO2还原法:化工厂常用SO2处理含铬废水,其工艺流程如下图所示:
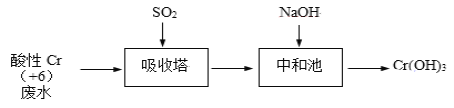
已知:Cr2O72- + H2O ![]() 2CrO42- + 2H+,吸收塔中 Cr2O72-与SO2反应如下:Cr2O72﹣(aq)+3SO2(g)+2H+(aq)═2Cr3+(aq)+3SO42﹣(aq)+H2O(l) ΔH = -1145 kJ/mol。
2CrO42- + 2H+,吸收塔中 Cr2O72-与SO2反应如下:Cr2O72﹣(aq)+3SO2(g)+2H+(aq)═2Cr3+(aq)+3SO42﹣(aq)+H2O(l) ΔH = -1145 kJ/mol。
(1)其他条件不变,研究吸收塔中pH对反应的影响。
pH | 2 | 4 | 6 |
Cr(+6)最大去除率 | 99.99%达排放标准 | 99.95%达排放标准 | 99.5%未达排放标准 |
时间 | 30 min | 35 min | 45 min |
①由上述数据获得的结论有_________。
②实际工业生产控制pH = ____左右。
③下列说法不合理的是_____。
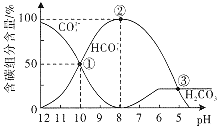
a.该酸性含铬废水中一定含有CrO42-,pH越大其含量越高
b.其他条件不变,增大压强,吸收塔中反应的K增大,有利于除去Cr(+6)
c.理论上看,SO32-、Fe2+等也可以用于除去Cr(+6)
(2)其他条件不变,研究温度对Cr(+6)去除率的影响(如图所示)。
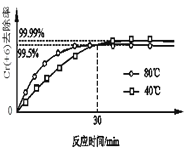
已知:30min前相同时间内,80℃的Cr(+6)去除率比40℃高,是因为30min前反应正向进行,温度高反应速率快反应物的转化率增大;试解释30min后80℃的Cr(+6)去除率低的原因:________。
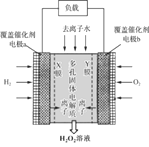
Ⅱ、电解法处理:
工业上处理含Cr2O72-离子的酸性废水,采用往工业废水中加入适量的食盐,再用Fe为电极进行电解,将Cr2O72—离子还原为可溶性三价铬离子,再调pH使三价铬离子变为不溶性氢氧化物除去。
(1)加入食盐的目的是 _______;
(2)电解时阳极反应式为 _________。