题目内容
3.将33.6gNa2CO3和NaHCO3固体混合物加热到300℃充分反应后,将生成的气体通入澄清石灰水中得到10g白色沉淀.已知碳酸钠固体不分解,碳酸氢钠分解的方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.求:(1)加热产生的二氧化碳在标准状况下的体积.
(2)原混合物中NaHCO3的质量分数.(写出计算过程)
分析 生成的沉淀为碳酸钙,计算出碳酸钙的物质的量,然后根据反应的关系式计算出生成二氧化碳的物质的量及原混合物中含有的碳酸氢钠的物质的量,再计算出标况下二氧化碳的体积和原混合物中NaHCO3的质量分数,由此分析解答.
解答 解:10g沉淀为CaCO3,n(CaCO3)=$\frac{10g}{100g/mol}$=0.1mol,根据反应关系式:CaCO3~CO2,可知n(CO2)=n(CaCO3)=0.1mol,
(1)标况下生成的二氧化碳的体积为:V(CO2)=22.4L/mol×0.1mol=2.24L,
答:生成的CO2气体体积(标准状况下)为2.24L;
(2)根据反应关系式:2NaHCO3~CO2,n(NaHCO3)=2n(CO2)=2×0.1mol=0.2mol,
原混合物中碳酸氢钠的质量为n(NaHCO3)=84g/mol×0.2mol=16.8g,
原混合物中碳酸钠的质量分数为w(NaHCO3)=$\frac{16.8g}{33.6g}$×100%=50%,
答:原混合物中碳酸钠的质量分数为50%.
点评 本题考查利用化学反应方程式进行的混合物的计算,清楚发生的化学反应是解答本题的关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.通常情况下加入氧化剂能实现的变化是( )
| A. | MnO2→MnSO4 | B. | Na2O2→O2 | C. | KI→KIO3 | D. | AlCl3→Al(OH)3 |
11.V mL Al2(SO4)3溶液中含有Al3+a g,取$\frac{1}{4}$V mL溶液稀释到4V mL,则稀释后溶液中S042-的物质的量浓度是( )
| A. | $\frac{125a}{9V}$mol•L -1 | B. | $\frac{125a}{18V}$mol•L -1 | C. | $\frac{125a}{36V}$mol•L -1 | D. | $\frac{125a}{54V}$mol•L -1 |
18.氧化还原反应中水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等.下列反应与Br2+SO2+2H2O═H2SO4+2HBr相比较,水的作用不相同的是( )
| A. | 2Cu+O2+CO2+H2O═Cu2(OH)2CO3 | B. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||
| C. | 2F2+2H2O═4HF+O2 | D. | Cl2+H2O?HCl+HClO |
8.下列说法正确的是( )
| A. | 投入铁片产生H2的溶液中可大量存在H+、Mg2+、SO42-、NO3- | |
| B. | 可用稀硝酸除去试管内壁上的银镜 | |
| C. | 1.0 mol•L-1的KNO3溶液中可大量存在H+、Fe2+、Cl-、SO42- | |
| D. | 硫化铜溶于硝酸的离子方程式为CuS+2H+═H2S↑+Cu2+ |
12.下列叙述不正确的是( )
| A. | 分散质粒子的半径在10-9m~10-7m之间的分散系叫做胶体 | |
| B. | 少量金属钠可保存在煤油中 | |
| C. | CO2水溶液能导电,因此CO2是电解质 | |
| D. | 汤姆生、卢瑟福、玻尔等科学家对原子结构模型的提出作出了很大贡献 |
13.下列实验方法能达到实验目的是( )
| A. | 用丁达尔效应可以鉴别溶液和胶体 | |
| B. | 用分液漏斗分离碘与CCl4的混合液 | |
| C. | 某溶液中滴加AgNO3溶液有白色沉淀,说明原溶液中有Cl- | |
| D. | 某溶液中滴加NaOH溶液有蓝色沉淀,说明原溶液中有Cu2+ |
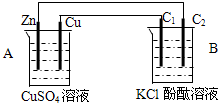 按如图装置进行实验,并回答下列问题
按如图装置进行实验,并回答下列问题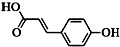 )主要用于制备香辛樱桃、杏、蜂蜜等香料.
)主要用于制备香辛樱桃、杏、蜂蜜等香料.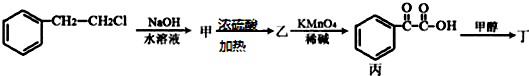
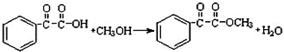
 (任写一个即可).
(任写一个即可).