题目内容
【题目】某小组为探究 AgNO3溶液和不同类型盐溶液反应的多样性,设计如图实验:
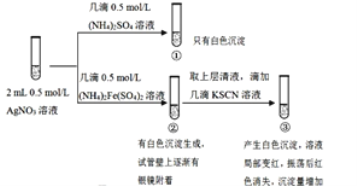
已知:AgSCN为白色难溶物。
下列说法中,不正确的是
A.向①的试管中滴加 0.5 mol/L KI溶液,有黄色沉淀生成证明存在Ag2SO4(s)+2I![]() 2AgI(s)+SO42
2AgI(s)+SO42
B.①中的白色沉淀是Ag2SO4
C.②中发生了氧化还原反应
D.对于③中红色褪去的原因可能与平衡移动原理有关
【答案】A
【解析】
A.①中硝酸银是过量的,再加入KI和硝酸银反应生成沉淀,不是沉淀转化,故A错误;
B.硝酸银溶液中滴入硫酸铵,生成白色沉淀为硫酸银,化学式为Ag2SO4,故B正确;
C.②中硝酸银溶液中滴入硫酸亚铁铵,有白色沉淀生成是生成的硫酸银,试管壁有银析出,可能发生银离子氧化亚铁离子为铁离子,银离子被还原为银单质,反应的离子方程式为Ag++Fe2+=Ag+Fe3+,②发生了氧化还原反应,故C正确;
D.红色褪去的原因与平衡移动原理有关,局部溶液发生反应Fe3++3SCN-![]() Fe(SCN)3,当振荡试管时,溶液中过量银银离子与硫氰根反应生成白色沉淀AgSCN,降低了硫氰根离子的浓度,上述平衡逆向进行溶液褪色,故D正确;
Fe(SCN)3,当振荡试管时,溶液中过量银银离子与硫氰根反应生成白色沉淀AgSCN,降低了硫氰根离子的浓度,上述平衡逆向进行溶液褪色,故D正确;
故答案为A。

【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.其他条件不变,升高温度,此反应的平衡常数增大
B.反应前2min的平均速率ν(Z)=4.0×10-3mol·L-1·min-1
C.其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正)
D.其他条件不变,再充入0.2mol Z,平衡时X的体积分数增大