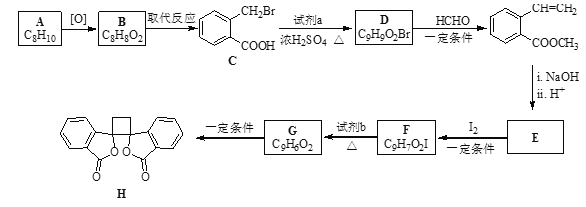
题目内容
【题目】某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再生利用.某校研究小组尝试回收废旧正极材料中的钴。
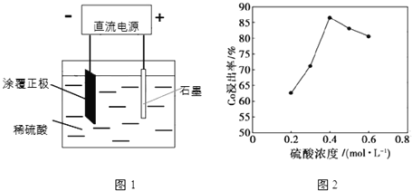
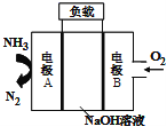
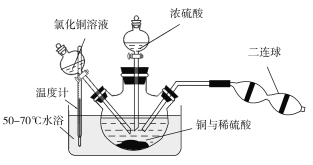
(1)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。
①阴极的电极反应式为:LiCoO2+4H++e-=Li++Co2++2H2O,阳极的电极反应式为______。
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4)>0.4molL-1时,钴的浸出率下降,其原因可能为______。
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。用以下步骤继续回收钴。

①写出“酸浸”过程中正极粉发生反应的化学方程式______。该步骤一般在80℃以下进行,温度不能太高的原因是______。
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是______(填字母序号)。
a.c(NH4+)>c(C2O42-)>c(H+)>c(OH-)
b.c(H+)+c(NH4+)=c(OH-)+c(HC2O4-)+c(HC2O42-)
c.c(NH4+)+c(NH3H2O)=2[c(HC2O42-)+c(HC2O4-)+c(H2C2O4)]
【答案】4OH——4e—=O2↑+2H2O H+与LiCoO2在阴极的还原反应相互竞争,当c(H+)增大时,参与放电的H+增多(或有利于H+放电),所以钴的浸出率下降 2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O 防止H2O2剧烈分解 ac
【解析】
(1)①阴离子在阳极放电,发生失电子的氧化反应,阳极氢氧根放电:4OH--4e-=O2↑+2H2O;
②电解过程中氢离子也可能在阴极放电,H+与LiCoO2在阴极的还原反应相互竞争,当c(H+)增大时,参与放电的H+增多(或有利于H+放电),所以钴的浸出率下降;
(2)①“酸浸”过程中正极粉发生氧化还原反应,根据流程可知反应物有LiCoO2、H2O2、H2SO4,生成物中有Co2+,则该过程中Co元素被还原,则H2O2中氧元素被氧化,产物中应该有氧气,结合电子守恒和元素守恒可得方程式为2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O;该步骤一般在80℃以下进行,反应物中有双氧水,双氧水不稳定,温度太高,双氧水会受热分解;
②(NH4)2C2O4溶液呈弱酸性,所以铵根的水解程度大于草酸根的水解程度,则
a.(NH4)2C2O4可以电离出两个铵根和一个草酸根,水解是微弱的,所以c(NH4+)>c(C2O42-)>c (H+)>c (OH-),故a正确;
b.由电荷守恒,可知c(H+)+c(NH4+)=c(OH-)+c(HC2O4-)+2c(C2O42-),故b错误;
c.由物料守恒,可知c(NH4+)+c(NH3H2O)=2[c(C2O42-)+c(HC2O4-)+c(H2C2O4)],故c正确;
故答案为:ac。

 名校课堂系列答案
名校课堂系列答案【题目】在A~I的元素中选择符合题意的元素,按要求回答下列问题:
族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | G | |||||
3 | B | C | J | F | H | I |
(1)只有负价而无正价的是______(填元素名称);
(2)最高价氧化物的水化物酸性最强的是____(填化学式);
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的化合物的结构式 _____;
(4)在B、C、D、J、 E、F、G、H中,原子半径最大的是____(填原子符号);
(5)画出上述元素中金属性最强的元素的原子结构示意图______;
(6)C单质与氢氧化钠溶液反应的离子方程式________________________;
(7)用电子式表示E单质的形成过程_______________________
(8)写出冶炼B单质的化学方程式____________________;
(9)D的最简单氢化物的燃烧热为890.3 kJ/mol,写出D的最简单氢化物燃烧热的热化学方程式_____;
(10)写出NaHSO4熔融时电离方程式______________________。