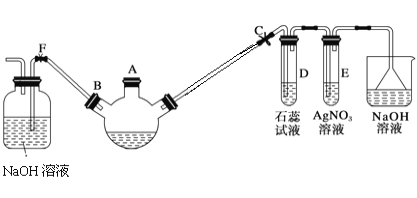
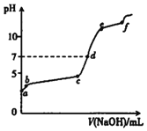
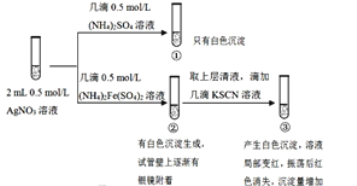
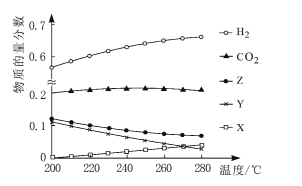
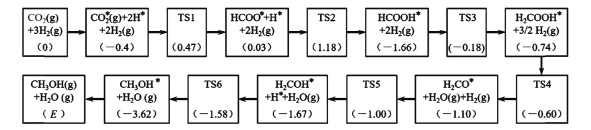
题目内容
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.其他条件不变,升高温度,此反应的平衡常数增大
B.反应前2min的平均速率ν(Z)=4.0×10-3mol·L-1·min-1
C.其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正)
D.其他条件不变,再充入0.2mol Z,平衡时X的体积分数增大
【答案】B
【解析】
A. 该反应焓变小于零正反应为放热反应,升高温度平衡常数减小,故A错误;
B. 2min内Y物质的量变化为0.16mol-0.12mol=0.04mol,故v(Y)= =0.002mol/(Lmin),速率之比等于化学计量数之比,故v(Z)=2v(Y)=2×0.002mol/(Lmin)=0.004mol/(Lmin),故B正确;
=0.002mol/(Lmin),速率之比等于化学计量数之比,故v(Z)=2v(Y)=2×0.002mol/(Lmin)=0.004mol/(Lmin),故B正确;
C. 该反应正反应是放热反应,降低温度平衡向正反应移动,反应达到新平衡前v(逆)<v(正),故C错误;
D. 该反应前后气体系数之和相等,所以压强不影响反应平衡,再通入0.2molZ,平衡后与原平衡达到等效平衡,X的体积分数不变,故D错误;
故答案为B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】苯乙烯(![]() )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
![]() (g)
(g)![]()
![]() (g)+H2(g) △H
(g)+H2(g) △H
(1)已知:
化学键 | C-H | C-C | C=C | H-H |
键能/kJ/mol | 412 | 348 | 612 | 436 |
计算上述反应的△H=________ kJ·mol-1。
(2)500℃时,在恒容密闭容器中,充入a mol乙苯,反应达到平衡后容器内气体的压强为P;若再充入bmol的乙苯,重新达到平衡后容器内气体的压强为2P,则a_______b(填“>” “<”或“=”),乙苯的转化率将________(填“增大” “减小”或“不变”)。
(3)工业上,通常在乙苯(EB)蒸气中掺混N2(原料气中乙苯和N2的物质的量之比为1︰10,N2不参与反应),控制反应温度600℃,并保持体系总压为0.1Mpa不变的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:

①A,B两点对应的正反应速率较大的是________。
②掺入N2能提高乙苯的平衡转化率,解释说明该事实___________________________。
③用平衡分压代替平衡浓度计算600℃时的平衡常数Kp=________。(保留两位有效数字,分压=总压×物质的量分数)
④控制反应温度为600℃的理由是___________________________。