题目内容
(1)25 ℃时,合成氨反应的热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
①在该温度时,取l mol N2和3 mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是_______92.4 kJ。(填“小于”, “大于” 或“等于”)
②一定条件下,上述可逆反应在体积固定的密闭容器中进行,下列叙述能说明反应已达到平衡的是_______________。
| A.NH3生成的速率与NH3分解的速率相等 |
B.混合气体的反应速率 v正(NH3)=v逆(H2) v正(NH3)=v逆(H2) |
| C.容器内的密度不再变化 |
| D.单位时间内消耗a mol N2,同时生成2a mol NH3 |
 值将_____(填“增大”, “减小” 或“不变”)。
值将_____(填“增大”, “减小” 或“不变”)。(3)常温下,向0.001mol/LAlCl3溶液中通入NH3直至过量,当PH=_________时,开始生成沉淀(已知:Ksp[Al(OH)3]=1.0×10-33)
(1)①小于 ….1分 ②A …. 2分
(2)10-5 ….2分 增大….1分 (3) 4 ….2分。
解析试题分析:(1)①因为可逆反应不可能完全进行到底,放出的热量比完全反应少,②A.氨的生成速率与氨的分解速率相等,正逆反应速率相等(同种物质),说明到达平衡状态,正确;B.混合气体的反应速率v正(NH3)= v逆(H2)时,各物质的浓度才能保持不变,错误;C.根据质量守恒,反应前后混合物的质量不变,容器的体积不变,所以密度始终不变,错误;D.单位时间内消耗n mol N2的同时必定生成2n mol NH3,不能说明反应v正=v逆,错误。
v逆(H2)时,各物质的浓度才能保持不变,错误;C.根据质量守恒,反应前后混合物的质量不变,容器的体积不变,所以密度始终不变,错误;D.单位时间内消耗n mol N2的同时必定生成2n mol NH3,不能说明反应v正=v逆,错误。
(2)氨水溶液PH=11,则C(H+)═10-11 mol?L-1,C(0H-)═10-3mol?L-1,
NH3?H2O ? NH4++ OH-
起始(mol?L-1) 0.1 0 0
反应(mol?L-1) 10-3 10-3 10-3
平衡(mol?L-1) 0.1 10-3 10-3
所以NH3?H2O的电离平衡常数为Kb=(10-3×10-3)/0.1==1.0×10-5mol?L-1;故答案为:
1.0×10-5mol?L-1;向此溶液中加入少量的氯化铵固体,平衡逆向移动,c(NH4+)增大,c(OH-)减小,此时 值将增大。
值将增大。
考点:化学平衡建立的过程化学平衡状态的判断

某些金属及金属氧化物对H2O2的分解反应具有催化作用,请回答下列问题: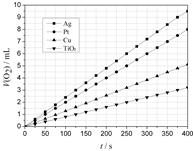
(1)已知:2H2O2(aq) =" 2" H2O (l) + O2(g) 的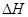 < 0, 则该反应的逆反应能否自发进行? (填“能”或“不能”),判断依据是 。
< 0, 则该反应的逆反应能否自发进行? (填“能”或“不能”),判断依据是 。
(2)某同学选用Ag、Pt、Cu、TiO2作为催化剂,在25℃ 时,保持其它实验条件相同,测得生成的O2体积(V)。V与分解时间(t)的关系如图所示(O2的体积已折算成标准状况),则:在不同催化剂存在下,H2O2分解反应的活化能大小顺序是 Ea( ) > Ea( ) > Ea( ) > Ea( ) (括号内填写催化剂的化学式)金属Pt 催化下,H2O2分解的反应速率v(O2) = mol·s-1
(3)为研究温度对H2O2分解速率的影响(不加催化剂),可将一定浓度和体积的H2O2置于密闭容器中,在某温度下,经过一定的时间t,测定生成O2的体积V。然后保持其它初始条件不变,改变温度T,重复上述实验。获得V(O2) ~ T关系曲线。下列趋势图最可能符合实测V(O2) ~ T关系曲线的是 ,原因是 。
| A. | B. | C. | D. (4)以Pt为电极电解H2O2也可产生氧气,写出H2O2水溶液电解过程中的电极反应式(已知:H2O2的氧化性及还原性均比H2O强):阴极;阳极 。 |
在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g)+Q(Q>0),
2NH3(g)+Q(Q>0),
(1)该反应所用的催化剂是 (填写名称)
该反应450℃的平衡常数 500℃时的平衡常数(填“>”、“<”或“=”)。
(2)下列描述中能说明上述反应已达平衡的是
| A.3V正(H2)=2V逆(NH3) | B.容器中气体的平均分子量不随时间而变化 |
| C.容器中气体的密度不随时间而变化 | D.容器中气体的分子总数不随时间而变化 |
(4)下列研究目的和示意图相符的是 。
| | A | B | C | D |
| 研究目的 | 压强对反应的影响(P1>P2) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 |  |  |  |  |
碳单质在工业上有多种用途。例如焦炭可用来制取水煤气、冶炼金属,活性炭可处理大气污染物NO。
一定条件下,在2 L密闭容器中加入NO和活性炭(无杂质)反应生成气体A和B。当温度在T1℃时,测得各物质平衡时物质的量如下表:
| | 活性炭 (mol) | NO (mol) | A (mol) | B (mol) |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| 平衡 | 2.000 | 0.040 | 0.030 | 0.030 |
(1)在T1℃时,达到平衡共耗时2分钟,则NO的平均反应速率为 mol/(L·min);当活性炭消耗0.015mol时,反应的时间 (填“大于”、“小于”或“等于”)1分钟。
(2)在T1℃下反应达到平衡后,下列措施不能改变NO的转化率的是 。
a.增大活性炭的量 b.增大压强 c.升高温度 d.移去部分B
(3)结合上表数据,该反应的平衡常数表达式为 。(生成物A、B用相应的化学式表示)若T1℃时的平衡常数为K1,T2℃时的平衡常数为K2,且K1>K2,能否判断该反应是吸热反应还是放热反应,说明理 。
(1)将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
H2NCOONH4(s) 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度(×10—3 mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①氨基甲酸铵分解反应的焓变△H 0(填“>”、“<”或“=”)。
②可以判断该分解反应已经达到化学平衡的是____。
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
③根据表中数据,计算25.0℃时的分解平衡常数为 。
(2)25℃时,NH3.H2O电离常数Kb=1.8×10—5,Mg(OH)2的溶度积常数Ksp=1.8×10—11,用pH计测得0.5 mol/L氨水溶液的pH约为 。在某氯化镁溶液中加入一定量的某浓度的烧碱后,测得混合液pH =11.0,则此温度下残留在溶液中的c(Mg2+)=____。(已知lg2≈0.3、lg3≈0.5)。
 2NH3(g) ΔH<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g) ΔH<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:

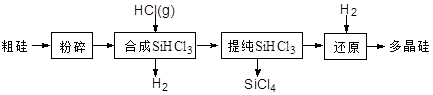
 Si (s) + 3HCl (g) ΔH >0,其平衡常数表达式为K = 。为提高还原时SiHCl3的转化率,可采取的措施有 。
Si (s) + 3HCl (g) ΔH >0,其平衡常数表达式为K = 。为提高还原时SiHCl3的转化率,可采取的措施有 。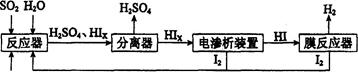
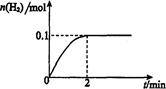
 H2(g)十I2 △H>0。若在一定条件下密闭容器中加入l mol HI(g), n(H2)随时间(t)的变化如图所示:
H2(g)十I2 △H>0。若在一定条件下密闭容器中加入l mol HI(g), n(H2)随时间(t)的变化如图所示: