ƒøƒ⁄»ð
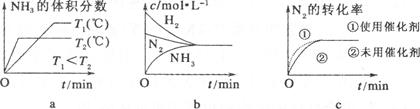
‘⁄“ªπÃ∂®»ðª˝Œ™2Lµƒ√б’»ð∆˜ƒ⁄º”»Î0£Æ2 molµƒN2∫Õ0£Æ6 molµƒH2£¨‘⁄“ª∂®Ãıº˛œ¬∑¢…˙»Áœ¬∑¥”¶£∫N2(g)£´3H2(g) 2NH3(g)£´Q£®Q£æ0£©,
2NH3(g)£´Q£®Q£æ0£©,
£®1£©∏√∑¥”¶À˘”√µƒ¥þªØº¡ « £®ÃÓ–¥√˚≥∆£©
∏√∑¥”¶450°Êµƒ∆Ω∫‚≥£ ˝ 500°Ê ±µƒ∆Ω∫‚≥£ ˝£®ÃÓ°∞>°±°¢°∞<°±ªÚ°∞=°±£©°£
£®2£©œ¬¡–√Ë ˆ÷–ƒÐÀµ√˜…œ ˆ∑¥”¶“—¥Ô∆Ω∫‚µƒ «
| A£Æ3V’˝£®H2£©£Ω2VƒÊ£®NH3£© | B£Æ»ð∆˜÷–∆¯Ãµƒ∆Ωæ˘∑÷◊”¡ø≤ªÀÊ ±º‰∂¯±‰ªØ |
| C£Æ»ð∆˜÷–∆¯Ãµƒ√Ð∂»≤ªÀÊ ±º‰∂¯±‰ªØ | D£Æ»ð∆˜÷–∆¯Ãµƒ∑÷◊”◊Ð ˝≤ªÀÊ ±º‰∂¯±‰ªØ |
£®4£©œ¬¡–—–æøƒøµƒ∫Õ æ“‚Õºœý∑˚µƒ « °£
| | A | B | C | D |
| —–æøƒøµƒ | —π«ø∂‘∑¥”¶µƒ”∞œÏ£®P1>P2£© | Œ¬∂»∂‘∑¥”¶µƒ”∞œÏ | ∆Ω∫‚ÃÂœµ‘ˆº”N2∂‘∑¥”¶µƒ”∞œÏ | ¥þªØº¡∂‘∑¥”¶µƒ”∞œÏ |
| Õº æ |  |  |  |  |
£®1£©Ã˙¥•√Ω£¨©É
£®2£©B D
£®3£©0£Æ01 mol/L
£®4£©C
Ω‚Œˆ ‘Â∑÷Œˆ£∫£®1£©∏√∑¥”¶À˘”√µƒ¥þªØº¡ «¥•√Ω£¨”…”⁄∏√∑¥”¶ «∑≈»»∑¥”¶£¨…˝∏þŒ¬∂»∆Ω∫‚ƒÊœÚ“∆∂Ø£¨π ∏√∑¥”¶450°Êµƒ∆Ω∫‚≥£ ˝”¶∏√¥Û”⁄500°Ê ±µƒ∆Ω∫‚≥£ ˝°£
£®2£©”…”⁄»ð∆˜÷–∆¯Ãµƒ∆Ωæ˘∑÷◊”¡ø∫Õ»ð∆˜÷–∆¯Ãµƒ√Ð∂»»Áπ˚√ª”–∆Ω∫‚ º÷’‘⁄∑¢…˙◊≈±‰ªØ£¨π —°BD°£
£®3£©∏˘æð∑¥”¶ÀŸ¬ µƒº∆À„π´ Ωø…«Ûµ√v(N2)Œ™0£Æ01mol/(L¯min)°£
£®4£©A£Æ∑¥”¶ŒÔ∆¯Ãµƒº∆¡ø ˝¥Û”⁄…˙≥…ŒÔ∆¯Ãµƒº∆¡ø ˝£¨‘Ú‘ˆ¥Û—π«ø∆Ω∫‚œÚ’˝∑¥”¶∑ΩœÚ“∆∂Ø£¨∞±∆¯µƒÃª˝∑÷ ˝‘ˆ¥Û£¨—π«ø‘Ω¥Û∑¥”¶ÀŸ¬ ‘Ω¥Û£¨ÕºœÛ≤ª∑˚£¨π A¥ÌŒÛ£ªB£Æ’˝∑¥”¶∑≈»»£¨‘Ú…˝∏þŒ¬∂»∆Ω∫‚œÚƒÊ∑¥”¶∑ΩœÚ“∆∂Ø£¨µ™∆¯µƒ◊™ªØ¬ ΩµµÕ£¨ÕºœÛ≤ª∑˚£¨π B¥ÌŒÛ£ªC£Æ‘ˆº”µ™∆¯£¨’˝∑¥”¶ÀŸ¬ ‘ˆ¥Û£¨º”»Îµ™∆¯À≤º‰ƒÊ∑¥”¶ÀŸ¬ ≤ª±‰£¨»ª∫Û÷Ω•‘ˆ¥Û£¨÷ÿ–¬¥ÔµΩ∆Ω∫‚◊¥Ã¨£¨ÕºœÛ∑˚∫œ£¨π C’˝»∑£ªD£Æº”»Î¥þªØº¡£¨∑¥”¶ÀŸ¬ ‘ˆ¥Û£¨¥ÔµΩ∆Ω∫‚À˘”√ ±º‰…Ÿ£¨ÕºœÛ≤ª∑˚∫œ£¨π D¥ÌŒÛ£Æπ —°C£Æ
øºµ„£∫±æÂøº≤Ȫؗß∑¥”¶ÀŸ¬ ∫Õ∆Ω∫‚◊¥Ã¨µƒ≈–∂œŒ £¨Ã‚ƒøƒ—∂»≤ª¥Û£¨

 √˚–£øŒÃ√œµ¡–¥∞∏
√˚–£øŒÃ√œµ¡–¥∞∏KI»Ð“∫‘⁄À·–‘Ãıº˛œ¬ƒÐ”Ηı∆¯∑¥”¶°£œ÷”–“‘œ¬ µ—Ⱥ«¬º£∫
| µ—ȱý∫≈ | ¢Ÿ | ¢⁄ | ¢€ | ¢Ð | ¢ð |
| Œ¬∂»£®°Ê£© | 30 | 40 | 50 | 60 | 70 |
| œ‘…´ ±º‰£®s£© | 160 | 80 | 40 | 20 | 10 |
£®1£©∏√∑¥”¶µƒ¿Î◊”∑Ω≥Ã ΩŒ™ °£
£®2£©∏√ µ—ȵƒƒøµƒ « °£
£®3£© µ—È ‘º¡≥˝¡À1 mol/L KI»Ð“∫°¢0.1 mol/L H2SO4»Ð“∫Õ‚£¨ªπ–Ë“™µƒ ‘º¡ « £¨ µ—Èœ÷œÛŒ™ °£
£®4£©…œ ˆ µ—È≤Ÿ◊˜÷–≥˝¡À–Ë“™£®3£©µƒÃıº˛Õ‚£¨ªπ±ÿ–Îøÿ÷∆≤ª±‰µƒ « (ÃÓ◊÷ƒ∏)°£
A£ÆŒ¬∂» B£Æ ‘º¡µƒ≈®∂» C£Æ ‘º¡µƒ”√¡ø(ê˝) D£Æ ‘º¡Ã̺”µƒÀ≥–Ú
£®5£©”……œ ˆ µ—Ⱥ«¬ºø…µ√≥ˆµƒΩ·¬€ « °£
£®6£©»Ù“™Ω¯––À·–‘∂‘∑¥”¶ÀŸ¬ µƒ”∞œÏµƒÃΩæø µ—È£¨ƒ„ª·≤…»°µƒ¥Î © « °£
(14∑÷)ƒ≥ªØ—ß∑¥”¶2A(g) B(g)+D(g)‘⁄Àƒ÷÷≤ªÕ¨Ãıº˛œ¬Ω¯––£¨B°¢D∆ º≈®∂»Œ™¡„£¨∑¥”¶ŒÔAµƒ≈®∂»(mol/L)ÀÊ∑¥”¶ ±º‰(min)µƒ±‰ªØ«Èøˆ£¨∏˘æ𜬠ˆ ˝æð£¨ÕÍ≥…œ¬¡–ÃÓø’£∫
B(g)+D(g)‘⁄Àƒ÷÷≤ªÕ¨Ãıº˛œ¬Ω¯––£¨B°¢D∆ º≈®∂»Œ™¡„£¨∑¥”¶ŒÔAµƒ≈®∂»(mol/L)ÀÊ∑¥”¶ ±º‰(min)µƒ±‰ªØ«Èøˆ£¨∏˘æ𜬠ˆ ˝æð£¨ÕÍ≥…œ¬¡–ÃÓø’£∫
| µ—È –Ú∫≈ | Œ¬∂»/°Ê | ±º‰/min | ||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | ||
| 1 | 800°Ê | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800°Ê | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800°Ê | c 3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820°Ê | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)‘⁄ µ—Èlπ˝≥Ã÷–£¨10 min°´20 min ±º‰ƒ⁄”√B±Ì æ∏√∑¥”¶µƒ∆Ωæ˘ªØ—ß∑¥”¶ÀŸ¬ Œ™ mol/(L°§min)°£
(2)‘⁄ µ—È2π˝≥Ã÷–£¨Aµƒ≥ı º≈®∂»c2= mol/L£¨∑¥”¶æ≠20minæÕ¥ÔµΩ∆Ω∫‚£¨ø…Õ∆≤‚ µ—È2÷–ªπ“˛∫¨µƒÃıº˛ « °£
(3)…Ë µ—È3µƒªØ—ß∑¥”¶ÀŸ¬ Œ™v3£¨ µ—È1µƒªØ—ß∑¥”¶ÀŸ¬ Œ™v1£¨‘Úv3 v1£¨«“c3 1.0 mol/L (ÃÓ°∞£º°±°¢°∞£æ°±ªÚ°∞=°±)°£
(4)±»Ωœ µ—È4∫Õ µ—Èl£¨ø…Õ∆≤‚∏√∑¥”¶ « ∑¥”¶(ÃÓ°∞Œ¸»»°±ªÚ°∞∑≈»»°±)°£¿Ì”… «
°£
≥£Œ¬œ¬∞¥’’»Áœ¬∑Ω∞∏ÕÍ≥… µ—È°£
| µ—ȱý∫≈ | ∑¥”¶ŒÔ | ¥þªØº¡ |
| ¢Ÿ | 10mL2% H2O2»Ð“∫ | ŒÞ |
| ¢⁄ | 10mL5% H2O2»Ð“∫ | ŒÞ |
| ¢€ | 10mL5% H2O2»Ð“∫ | 1mL0.1mol°§L£≠1FeCl3»Ð“∫ |
| ¢Ð | 10mL5% H2O2»Ð“∫£´…Ÿ¡øHCl»Ð“∫ | 1mL0.1mol°§L£≠1FeCl3»Ð“∫ |
| ¢ð | 10mL5% H2O2»Ð“∫£´…Ÿ¡øNaOH»Ð“∫ | 1mL0.1mol°§L£≠1FeCl3»Ð“∫ |
£®1£©¥þªØº¡ƒÐº”øϪؗß∑¥”¶ÀŸ¬ µƒ‘≠“Ú «_____________________________________°£
£®2£© µ—È¢Ÿ∫Õ¢⁄µƒƒøµƒ «____________________________°£ µ—È ±”…”⁄Ωœ≥§ ±º‰√ª”–π€≤ϵΩ√˜œ‘œ÷œÛ∂¯ŒÞ∑®µ√≥ˆΩ·¬€°£◊ ¡œœ‘ 棨ծ≥£Ãıº˛œ¬H2O2Œ»∂®£¨≤ª“◊∑÷Ω‚°£Œ™¡À¥ÔµΩ µ—ȃøµƒ£¨ƒ„∂‘‘≠ µ—È∑Ω∞∏µƒ∏ƒΩ¯ «____________________°£
£®3£©–¥≥ˆ µ—È¢€µƒªØ—ß∑¥”¶∑Ω≥Ã Ω °£
£®4£© µ—È¢€°¢¢Ð°¢¢ð÷–£¨≤‚µ√…˙≥…—ı∆¯µƒÃª˝ÀÊ ±º‰±‰ªØµƒπÿœµ»Áœ¬Õº°£
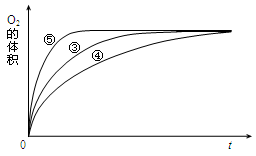
∑÷Œˆ…œÕºƒÐπªµ√≥ˆµƒ µ—ÈΩ·¬€ «______________________________________°£
I.∏þ¬Ø¡∂Ã˙µƒ÷˜“™∑¥”¶Œ™Fe2O3£´3CO2Fe£´3CO2°£
“—÷™∏√∑¥”¶µƒ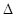 H£¨‘⁄1000°Ê ±£¨K=64°£‘⁄1000°ÊµƒÃı£¨‘⁄»ðª˝10 Lµƒ√б’»ð∆˜÷–£¨º”»ÎFe°¢Fe2O3°¢CO°¢CO2∏˜1£ÆOmoI£¨∑¥”¶æ≠10 min∫Û¥ÔµΩ∆Ω∫‚°£
H£¨‘⁄1000°Ê ±£¨K=64°£‘⁄1000°ÊµƒÃı£¨‘⁄»ðª˝10 Lµƒ√б’»ð∆˜÷–£¨º”»ÎFe°¢Fe2O3°¢CO°¢CO2∏˜1£ÆOmoI£¨∑¥”¶æ≠10 min∫Û¥ÔµΩ∆Ω∫‚°£
(1)∏√ ±º‰∑∂Œßƒ⁄µƒ∆Ωæ˘∑¥”¶ÀŸ¬ v(CO2£©=_________mol/L min
min
(2) µƒ◊Ó¥Û◊™ªØ¬ _________________°£
(3)”˚÷∏þCOµƒ∆Ω∫‚◊™ªØ¬ £¨ø…≤…»°µƒ¥Î © «_______________°£
| A£Æºı…ŸFeµƒ¡ø | B£Æ‘ˆº”Fe2O3µƒ¡ø |
| C£Æ…˝∏þ∑¥”¶Œ¬∂» | D£Æ“∆≥ˆ≤ø∑÷CO2 |
¢Ú£Æ“—÷™ªØ—ß∑¥”¶¢Ÿ£∫Fe£®s£©+CO2£®g£©
 FeO£®s£©+CO£®g£©£¨∆‰∆Ω∫‚≥£ ˝Œ™K1£ªªØ—ß∑¥”¶¢⁄£∫Fe£®s£©+H2O£®g£©
FeO£®s£©+CO£®g£©£¨∆‰∆Ω∫‚≥£ ˝Œ™K1£ªªØ—ß∑¥”¶¢⁄£∫Fe£®s£©+H2O£®g£© FeO£®s£©+H2£®g£©£¨∆‰∆Ω∫‚≥£ ˝K2£Æ‘⁄Œ¬∂»973K∫Õ1173K«Èøˆœ¬£¨K1°¢K2µƒ÷µ∑÷±»Áœ¬£∫
FeO£®s£©+H2£®g£©£¨∆‰∆Ω∫‚≥£ ˝K2£Æ‘⁄Œ¬∂»973K∫Õ1173K«Èøˆœ¬£¨K1°¢K2µƒ÷µ∑÷±»Áœ¬£∫| Œ¬∂» | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
(4)Õ®π˝±Ì∏Ò÷–µƒ ˝÷µø…“‘Õ∆∂œ£∫∑¥”¶¢Ÿµƒ°˜H_ O°££®ÃÓ°∞>°±°∞<°±£©
(5)œ÷”–∑¥”¶¢€£∫∏√∑¥”¶µƒ∆Ω∫‚≥£ ˝µƒ ˝—ß±Ì
¥Ô ΩK3=____°£
(6)∏˘æð∑¥”¶¢Ÿ∫Õ¢⁄ø…“‘Õ∆µº≥ˆKi£¨Kz∫Õ¬Í÷ƺ‰µƒπÿœµ Ω°£K3=__________°£æð¥Àπÿœµ Ω∫Õ…œ±Ì ˝æ𣨓≤ƒÐÕ∆∂œ≥ˆ∑¥”¶¢€µƒ°˜H_ _0(ÃÓ°∞>°±°∞<°±)°£
£®1£©25 °Ê ±£¨∫œ≥…∞±∑¥”¶µƒ»»ªØ—ß∑Ω≥Ã ΩŒ™£∫N2£®g£©+3H2£®g£© 2NH3£®g£© °˜H=£≠92.4 kJ/mol
2NH3£®g£© °˜H=£≠92.4 kJ/mol
¢Ÿ‘⁄∏√Œ¬∂» ±£¨»°l mol N2∫Õ3 mol H2∑≈‘⁄√б’»ð∆˜÷–£¨‘⁄¥þªØº¡¥Ê‘⁄œ¬Ω¯––∑¥”¶£¨≤‚µ√∑¥”¶∑≈≥ˆµƒ»»¡ø◊Ð «_______92.4 kJ°£(ÃÓ°∞–°”⁄°±£¨ °∞¥Û”⁄°± ªÚ°∞µ»”⁄°±)
¢⁄“ª∂®Ãıº˛œ¬£¨…œ ˆø…ƒÊ∑¥”¶‘⁄ê˝πÃ∂®µƒ√б’»ð∆˜÷–Ω¯––£¨œ¬¡–– ˆƒÐÀµ√˜∑¥”¶“—¥ÔµΩ∆Ω∫‚µƒ «_______________°£
| A£ÆNH3…˙≥…µƒÀŸ¬ ”ÎNH3∑÷Ω‚µƒÀŸ¬ œýµ» |
B£ÆªÏ∫œ∆¯Ãµƒ∑¥”¶ÀŸ¬  v’˝£®NH3£©=vƒÊ£®H2£© v’˝£®NH3£©=vƒÊ£®H2£© |
| C£Æ»ð∆˜ƒ⁄µƒ√Ð∂»≤ª‘Ÿ±‰ªØ |
| D£Æµ•Œª ±º‰ƒ⁄œ˚∫ƒa mol N2£¨Õ¨ ±…˙≥…2a mol NH3 |
 ÷µΩ´_____(ÃÓ°∞‘ˆ¥Û°±£¨ °∞ºı–°°± ªÚ°∞≤ª±‰°±)°£
÷µΩ´_____(ÃÓ°∞‘ˆ¥Û°±£¨ °∞ºı–°°± ªÚ°∞≤ª±‰°±)°££®3£©≥£Œ¬œ¬£¨œÚ0.001mol/LAlCl3»Ð“∫÷–Õ®»ÎNH3÷±÷¡π˝¡ø£¨µ±PH=_________ ±£¨ø™ º…˙≥…≥¡µÌ(“—÷™£∫Ksp[Al(OH)3]=1.0°¡10-33)
(14∑÷)𧓵÷∆œıÀ·µƒ÷˜“™∑¥”¶ «4NH3(g)+5O2(g)  4NO(g)+6H2O(g)¶§H=-akJ/mol(a©É0)
4NO(g)+6H2O(g)¶§H=-akJ/mol(a©É0)
(1)»Áπ˚Ω´4molNH3∫Õ5molO2∑≈»Î»ð∆˜÷–£¨¥ÔµΩ∆Ω∫‚ ±£¨∑≈≥ˆ»»¡ø0.8akJ£¨‘Ú∑¥”¶ ±◊™“∆µƒµÁ◊” ˝Œ™
mol
(2)»Ù∆‰À˚Ãıº˛≤ª±‰£¨œ¬¡–πÿœµÕº÷–¥ÌŒÛµƒ « £®—°ÃÓ–Ú∫≈£©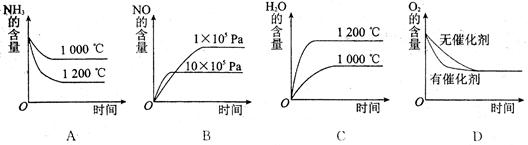
(3)t°Ê ±£¨‘⁄»ðª˝πÃ∂®µƒ√б’»ð∆˜÷–∑¢…˙…œ ˆ∑¥”¶£¨»ð∆˜ƒ⁄∏˜ŒÔ÷ µƒ≈®∂»»Áœ¬±Ì
| ≈®∂»(mol/L) ±º‰(min) | c(NH3) | c(O2) | c(NO) | c(H2O) |
| ∆ º | 4.0 | 5.5 | 0 | 0 |
| µ⁄2min | 3.2 | x | 0.8 | 1.2 |
| µ⁄4min | 2.0 | 3.0 | 2.0 | 3.0 |
| µ⁄6min | 2.0 | 3.0 | 2.0 | 3.0 |
¢Ÿ∑¥”¶‘⁄µ⁄2mimµΩµ⁄4mim ±£¨∑¥”¶ÀŸ¬ v(O2)=
¢⁄µ⁄2min ±∏ƒ±‰¡ÀÃıº˛£¨∏ƒ±‰µƒÃıº˛ø…ƒÐ «
A£Æ…˝∏þŒ¬∂» B£Æ π”√¡À¥þªØº¡ C£Æºı–°—π«ø D£Æ‘ˆº”¡À…˙≥…ŒÔ
¢€‘⁄œýÕ¨µƒŒ¬∂»œ¬£¨∆ ºœÚ»ð∆˜÷–º”»ÎNH3°¢O2°¢NO∫ÕH2O(g)µƒ≈®∂»∂ºŒ™1mol/L£¨‘Ú∏√∑¥”¶Ω´œÚ _______∑ΩœÚΩ¯––(ÃÓ°∞’˝∑¥”¶°±.°∞ƒÊ∑¥”¶°±.°∞≤ª“∆∂Ø°±)
£®4£©π§“µ…œ”√ÀÆŒ¸ ’∂˛—ıªØµ™…˙≤˙œıÀ·£¨…˙≥…µƒNO2∆¯ÃÂæ≠π˝∂ý¥Œ—ıªØ°¢Œ¸ ’µƒ—≠ª∑≤Ÿ◊˜ π∆‰≥‰∑÷◊™ªØŒ™œıÀ·£®ºŸ∂®…œ ˆπ˝≥Ã÷–ŒÞ∆‰À¸À ߣ©£¨œ÷”–23∂÷NO2æ≠π˝2¥Œ—ıªØŒ¸ ’µ√µΩ20®Gµƒœ°œıÀ· ∂÷°£
£®5£©≥…∆∑œıÀ·µƒ≈®∂»Œ™60%°´70%£¨Œ™¡À÷∆≈®œıÀ·£¨≥£”√Mg(NO3)2◊˜Œ¸Àƺ¡£¨»ª∫ÛΩ¯––’Ù¡Û£¨≤ª”√CaCl2ªÚMgCl2◊˜Œ¸Àƺ¡µƒ‘≠“Ú «__________________________________________
‘⁄2 L√б’»ð∆˜÷–£¨800 °Ê ±∑¥”¶2NO(g)£´O2(g)  2NO2(g)ÃÂœµ÷–£¨n(NO)ÀÊ ±º‰µƒ±‰ªØ»Áœ¬±Ì£∫
2NO2(g)ÃÂœµ÷–£¨n(NO)ÀÊ ±º‰µƒ±‰ªØ»Áœ¬±Ì£∫
| ±º‰(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
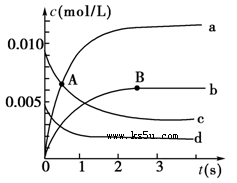
£®1£©Aµ„¥¶£¨v(’˝)________v(ƒÊ)£¨Aµ„’˝∑¥”¶ÀŸ¬ ________Bµ„’˝∑¥”¶ÀŸ¬ (”√°∞¥Û”⁄°±°¢°∞–°”⁄°±ªÚ°∞µ»”⁄°±ÃÓø’)°£
£®2£©»ÁÕº÷–±Ì æNO2µƒ±‰ªØµƒ«˙œþ «________°£”√O2±Ì 楔0°´2 sƒ⁄∏√∑¥”¶µƒ∆Ωæ˘ÀŸ¬ v£Ω________________°£
£®3£©ƒÐÀµ√˜∏√∑¥”¶“—æ≠¥ÔµΩ∆Ω∫‚◊¥Ã¨µƒ «________°£
a£Æv(NO2)£Ω2v(O2) b£Æ»ð∆˜ƒ⁄—π«ø±£≥÷≤ª±‰
c£ÆvƒÊ(NO)£Ω2v’˝(O2) d£Æ»ð∆˜ƒ⁄µƒ√Ð∂»±£≥÷≤ª±‰
£®4£©ƒÐ π∏√∑¥”¶µƒ∑¥”¶ÀŸ¬ ‘ˆ¥Ûµƒ «________°£
a£Æº∞ ±∑÷¿Î≥ˆNO2∆¯Ã b£Æ µ±…˝∏þŒ¬∂»
c£Æ‘ˆ¥ÛO2µƒ≈®∂» d£Æ—°‘Ò∏þ–ßµƒ¥þªØº¡
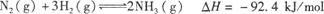 £¨æð¥Àªÿ¥“‘œ¬Œ £∫
£¨æð¥Àªÿ¥“‘œ¬Œ £∫