题目内容
水是生命之源,也是化学反应中的主角。请回答下列问题:
Ⅰ、氢气燃烧生成液态水热化学方程式是2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ/mol。
(1)生成物能量总和(填“大于”、“小于”或“等于”)反应物能量总和。
(2)若2 mol氢气完全燃烧生成水蒸气,则放出的热量 572 kJ(填“>”、“<”或“=”)。
(3)氢气热值为 。
Ⅱ、氢气和氧气反应生成水,将化学能转化为电能,其构造如图所示:a、b两个电极均由多孔的碳块组成。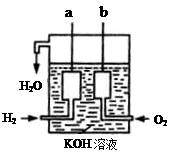
(1)a电极反应式是
(2)b电极反应式是
Ⅲ、如图表示一个电解池。X、Y都是惰性电极,电解液a是饱和食盐水,同时在两边各滴入几滴酚酞试液。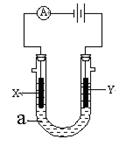
(1)X极上的电极反应式为 ,
在X极附近观察到的现象是 。
(2)Y极上的电极反应式为 ,
检验该电极反应产物的方法是 。
Ⅰ(1) 小于(2) <(3) 143 kJ/g
Ⅱ、(1) H2-2e- + 2OH-=2H2O(2)O2 + 4e- + 2H2O=4OH-
Ⅲ、(1) 2H+ + 2e-=H2↑ 或2H2O + 2e-=H2+2OH-↑;产生气泡,溶液变红
(2) 2Cl-- 2e-=Cl2↑;用湿润的淀粉碘化钾试纸检验,试纸变蓝(其它合理方法亦可)
解析

碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:
① H2(g)+I2(?) 2HI(g)+9.48kJ② H2(g)+I2(?)
2HI(g)+9.48kJ② H2(g)+I2(?) 2HI(g)-26.48kJ
2HI(g)-26.48kJ
下列判断正确的是
| A.①中的I2为固态,②中的I2为气态 |
| B.②的反应物总能量比①的反应物总能量低 |
| C.①的产物比反应②的产物热稳定性更好 |
| D.1mol 固态碘升华时将吸热17kJ |
氢气虽然是一种理想的绿色能源,但目前仍处在研究、实验阶段,还未得到广泛应用,其原因可能是
| A.氢气虽可由水制备获得,但水资源严重匮乏 |
| B.氢气制备耗能巨大,廉价制氢技术尚未成熟 |
| C.氢气贮存、运输等安全技术已经很好地解决了 |
| D.氢气燃烧产物虽无污染,但其放出热量较少 |
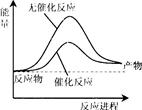
下列与化学反应能量变化相关的叙述正确的是
| A.生成物总能量一定低于反应物总能量 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.盖斯定律,可计算某些难以直接测量的反应的焓变 |
| D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的△H不同 |
如图所示是101kPa时,氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是( )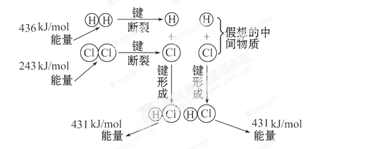
| A.此反应的热化学方程式为:H2(g)+Cl2(g) =2HCl(g) ΔH=+183kJ·mol-1 |
| B.2molHCl分子中的化学键形成时要释放862kJ能量 |
| C.1molH2中的化学键断裂时需要吸收436kJ能量 |
| D.此反应的热化学方程式为:1/2H2(g)+1/2Cl2(g) =HCl(g) ΔH=-91.5kJ·mol-1 |
已知:N2(g)+3H2(g) 2NH3(g)△H=" —92" kJ/mol,相关数据如下表。一定条件下,在体积为1L的密闭容器中加入1molN2和3molH2充分反应,放出热量Q1kJ,下列说法正确的是( )
2NH3(g)△H=" —92" kJ/mol,相关数据如下表。一定条件下,在体积为1L的密闭容器中加入1molN2和3molH2充分反应,放出热量Q1kJ,下列说法正确的是( )
| | H2(g) | N2(g) | NH3(g) |
| 1mol分子中的化学键形成时要释放出的能量/kJ | 436 | 946 | a |
B.a的数值为391
C.Q1的数值为92
D.相同条件下,反应物若为2molN2和6molH2,放出热量Q2>2Q1
已知:2H2(g) + O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2H2(g) + O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
下列说法正确的是
| A.H2(g)的燃烧热ΔH=-285.8 kJ·mol-1 |
| B.1molH2O(l)变成1mo1H2O(g),吸收88kJ能量 |
| C.3H2(g)+CO2(g)=CH3OH(l)+H2O(l)ΔH=+135.9 kJ·mol-1 |
| D.可以寻找特殊催化剂使H2O分解,同时放出能量 |
已知:S(s)+O2(g)→SO2(g) +297.16kJ,2SO2(g)+O2(g) 2SO3(g)+196.6 kJ,下列说法正确的是
2SO3(g)+196.6 kJ,下列说法正确的是
| A.1 molSO2(g)的能量总和大于lmol S(s)和l molO2(g)的能量总和 |
| B.将2 molSO2(g)与l molO2(g)在一定条件下充分反应,放出196.6kJ的热量 |
C.S(g)+O2(g) SO2(g)+Q,Q值小于297.16 kJ SO2(g)+Q,Q值小于297.16 kJ |
| D.当l mol S(s)完全转化为SO3(g)时(假设无热量损失),放出395.46kJ的热量 |