题目内容
已知:S(s)+O2(g)→SO2(g) +297.16kJ,2SO2(g)+O2(g) 2SO3(g)+196.6 kJ,下列说法正确的是
2SO3(g)+196.6 kJ,下列说法正确的是
| A.1 molSO2(g)的能量总和大于lmol S(s)和l molO2(g)的能量总和 |
| B.将2 molSO2(g)与l molO2(g)在一定条件下充分反应,放出196.6kJ的热量 |
C.S(g)+O2(g) SO2(g)+Q,Q值小于297.16 kJ SO2(g)+Q,Q值小于297.16 kJ |
| D.当l mol S(s)完全转化为SO3(g)时(假设无热量损失),放出395.46kJ的热量 |
D
解析试题分析:A、S燃烧生成SO2的反应是放热反应,所以1 molSO2(g)的能量总和小于lmol S(s)和l molO2(g)的能量总和,A不正确;B、反应2SO2(g)+O2(g) 2SO3(g) 是可逆反应,反应物的转化率得不到100%,因此将2 molSO2(g)与l molO2(g)在一定条件下充分反应,放出的热量小于196.6kJ,B不正确;C、气态S的能量高于固态S的能量,所以气态S燃烧放出的热量多,即S(g)+O2(g)→SO2(g)+Q,Q值大于297.16 kJ,C不正确;D、根据盖斯定律可知,S(s)+
2SO3(g) 是可逆反应,反应物的转化率得不到100%,因此将2 molSO2(g)与l molO2(g)在一定条件下充分反应,放出的热量小于196.6kJ,B不正确;C、气态S的能量高于固态S的能量,所以气态S燃烧放出的热量多,即S(g)+O2(g)→SO2(g)+Q,Q值大于297.16 kJ,C不正确;D、根据盖斯定律可知,S(s)+ O2(g)→SO3(g),所以该反应放出的热量是297.16kJ+
O2(g)→SO3(g),所以该反应放出的热量是297.16kJ+ ×196.6 kJ=395.46kJ,D正确,答案选D。
×196.6 kJ=395.46kJ,D正确,答案选D。
考点:考查反应热的有关判断和计算

 阅读快车系列答案
阅读快车系列答案已知在一定条件下,CO的燃烧热为283 kJ/mol,CH4的燃烧热为890 kJ/mol,由1 mol CO和3 mol CH4组成混合气体在上述条件下充分燃烧,释放的热量为
| A.2912 kJ | B.2953 kJ | C.3236 kJ | D.3867 kJ |
硫单质有两种常见的同素异形体:单斜硫和正交硫。已知常温常压下:
① S (s,单斜)+O2 (g)→SO2 (g)+297.16kJ;
② S (s,正交)+O2 (g)→SO2 (g)+296.83kJ
下列说法正确的是
| A.常温常压下单斜硫比正交硫稳定 |
B.单斜硫转变为正交硫的能量变化可用下图表示 |
| C.S(g)+O2(g)→SO2(g)+Q3 Q3>296.83kJ |
| D.反应①中生成1 L SO2 (g)放出297.16kJ热量 |
某废水处理厂处理废水中NH+的过程如下:
①NH4+(aq)+ O2(g)=HNO2(aq)+H+(aq)+H2O(1) ΔH="-b" KJ/mol
O2(g)=HNO2(aq)+H+(aq)+H2O(1) ΔH="-b" KJ/mol
②2HNO2(aq)+O2(g)=2NO3-(aq)+2H+ ΔH=-aKJ/mol
下列叙述正确的是( )
| A.将NH4+转化为NO3-的热化学方程式可表示为: NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(1)ΔH=-(b+  )KJ/mol )KJ/mol |
| B.在上述两次转化过程中,废水的酸性先增大然后逐渐减弱 |
| C.常温下,若HNO3溶液中c(H+)="0.1" mol·L-1,则该溶液的pH>1 |
| D.若上述两次转化完全,不考虑其它杂质离子的存在,则:c(NH4+)+c(OH-)=c(NO3-)+c(H+) |
关于化学能与热能的叙述,正确的是( )
| A.1mol酸与碱恰好中和时所放出的热量叫中和热 |
| B.化学反应中的能量变化,主要是由化学键的变化引起的 |
| C.燃料电池反应时,化学能降低 |
| D.反应物的总能量高于生成物总能量的反应,不需要加热就可自行反应 |
下列说法或表示方法正确的是 ( )
| A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B.由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ·mol-1可知,若将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ |
C.300℃、30MPa下,将0.5molN2(g)和1.5mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-38.6kJ·mol-1 2NH3(g) △H=-38.6kJ·mol-1 |
| D.由C(石墨)=C(金刚石)△H=" +1.90" kJ·mol-1可知,金刚石比石墨稳定 |
根据下图可以写出热化学方程式As2O5(s) = As2O3( s) +O2( g) △H =" a" kJ/mol。则a为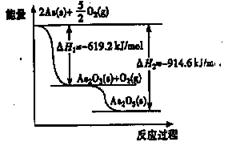
| A.+1533.8 | B.— 1533.8 | C.+295.4 | D.—295.4 |