题目内容
20.将一小块钠投入盛有5mL饱和石灰水的试管中,不可能观察到的现象是( )| A. | 钠熔成光亮的小球,在液面四处游动 | |
| B. | 有气体产生 | |
| C. | 溶液底部有银白色的物质 | |
| D. | 溶液变浑浊 |
分析 钠的密度小于水,熔点低,结合钠与盐溶于反应先与水反应,该反应为放热反应,氢氧化钙溶解度随着温度升高而降低,据此解答.
解答 钠的密度小于水,钠的熔点较低,钠和水反应生成氢氧化钠和氢气且放出热量,随着反应的进行水的量减少,氢氧化钙溶解度随着温度升高而降低,氢氧化钙溶液成为过饱和溶液,溶液中析出部分氢氧化钙,溶于变浑浊,
故选:C.
点评 本题考查了钠的性质,题目难度不大,根据钠的物理性质和化学性质分析钠和水反应现象.

练习册系列答案
相关题目
10.从石英砂制取并获得高纯硅的主要化学反应如下:
①SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗)+2CO↑
②Si(粗)+2Cl2$\frac{\underline{\;加热\;}}{\;}$SiCl4
③SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si(纯)+4HCl
关于上述反应的分析不正确的是( )
①SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗)+2CO↑
②Si(粗)+2Cl2$\frac{\underline{\;加热\;}}{\;}$SiCl4
③SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si(纯)+4HCl
关于上述反应的分析不正确的是( )
| A. | ①、③是置换反应,②是化合反应 | |
| B. | 高温下,焦炭与氢气的还原性均弱于硅 | |
| C. | 任一反应中,每消耗或生成28 g硅,均转移4 mol电子 | |
| D. | 在第三个反应中,SiCl4作氧化剂 |
11.已知: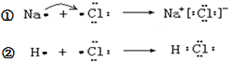 下列说法不正确的是( )
下列说法不正确的是( )
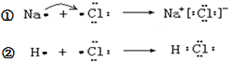 下列说法不正确的是( )
下列说法不正确的是( )| A. | ①和②变化过程中都会放出热量 | |
| B. | 氯原子吸引电子的能力强于钠原子和氢原子 | |
| C. | NaCl中含有离子键,HCl中含有极性共价键 | |
| D. | ①和②中的氯原子均得到1个电子达到8电子稳定结构 |
8.关于分子或离子中心原子的杂化轨道类型和空间构型,下列判断正确的是( )
| A. | PH3 sp2 平面三角形 | B. | SO32- sp2 平面三角形 | ||
| C. | SO2 sp2 V形 | D. | NO3- sp3 三角锥形 |
15.下列微粒中,只有氧化性的是( )
①Cl- ②Fe2+ ③Fe3+ ④S ⑤H+ ⑥Na+ ⑦Mg.
①Cl- ②Fe2+ ③Fe3+ ④S ⑤H+ ⑥Na+ ⑦Mg.
| A. | ①⑦ | B. | ②④ | C. | ③⑤⑥ | D. | ②④⑤⑥ |
5.下列有关碳酸钠和碳酸氢钠的说法不正确的是( )
| A. | 等质量的碳酸钠和碳酸氢钠分别与足量盐酸反应,碳酸氢钠产生的二氧化碳多 | |
| B. | 等物质的量的盐酸分别与足量的碳酸钠和碳酸氢钠反应,碳酸氢钠产生的二氧化碳多 | |
| C. | 相同温度在水中的溶解度:碳酸钠大于碳酸氢钠 | |
| D. | 用氢氧化钙溶液鉴别碳酸钠和碳酸氢钠两种溶液 |
10.人类认识原子结构的历史经历了以下几个重要发展阶段,请填写表:
除上述各阶段外,更早的是古典原子论,代表科学家是古希腊哲学家德谟克利特;发展至现在的是量子论,代表科学家为波尔.
| 发展阶段 | 原子结构模型 | 重要科学家 | 提出模型的主要依据 |
| (1) | 近代原子论 | 气体实验与观察 | |
| (2) | 汤姆孙 | ||
| (3) | 原子行星模型 |
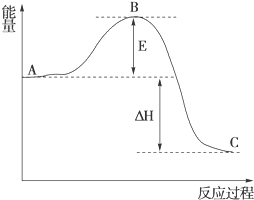 (1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,写出表示甲烷燃烧热的热化学方程式:CH4(g)+2O2(g)═CO2(g)+H2O(l)△H=-880kJ/mol.
(1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,写出表示甲烷燃烧热的热化学方程式:CH4(g)+2O2(g)═CO2(g)+H2O(l)△H=-880kJ/mol.