题目内容
3.下列实验装置(固定装置略去)和操作正确的是( )| A. | 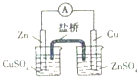 构成铜锌原电池 | B. | 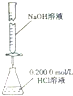 酸碱中和滴定 | C. | 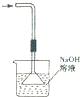 吸收HCl尾气 | D. | 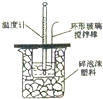 中和热的测定 |
分析 A.应将锌插入硫酸锌溶液中;
B.氢氧化钠溶液应放在碱式滴定管中;
C.产生倒吸;
D.发生中和反应,为避免热量损失,应绝热.
解答 解:A.锌直接置换出铜,不能形成原电池,应将锌插入硫酸锌溶液中,故A错误;
B.氢氧化钠溶液腐蚀玻璃塞,应放在碱式滴定管中,故B错误;
C.应将漏斗紧贴液面而不能插入液面以下,故C错误;
D.发生中和反应,温度计用于测量温度的变化,碎泡沫可起到隔热的作用,可用于测量中和热,故D正确.
故选D.
点评 本题考查较为综合,涉及原电池、滴定、尾气吸收以及中和热的测定等,为高频考点,侧重于学生的分析、实验能力的考查,注意把握物质的性质的异同以及实验的严密性和可行性的评价,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是( )
| A. | 58.5 g的氯化钠固体中含有NA个氯化钠分子 | |
| B. | 0.1 L 3 mo1•L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023 | |
| C. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023 | |
| D. | 4.5 g SiO2晶体中含有的硅氧键数目为0.3×6.02×1023 |
11.已知: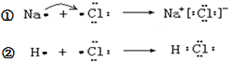 下列说法不正确的是( )
下列说法不正确的是( )
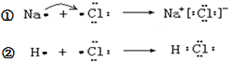 下列说法不正确的是( )
下列说法不正确的是( )| A. | ①和②变化过程中都会放出热量 | |
| B. | 氯原子吸引电子的能力强于钠原子和氢原子 | |
| C. | NaCl中含有离子键,HCl中含有极性共价键 | |
| D. | ①和②中的氯原子均得到1个电子达到8电子稳定结构 |
18.减少“酸雨”产生的措施:①少用煤作燃料;②把工厂烟囱升高;③在已酸化的土壤中加石灰;④燃料脱硫;⑤开发新能源.
其中有效措施是( )
其中有效措施是( )
| A. | ①②③ | B. | ②③④ | C. | ①④⑤ | D. | ①③④ |
8.关于分子或离子中心原子的杂化轨道类型和空间构型,下列判断正确的是( )
| A. | PH3 sp2 平面三角形 | B. | SO32- sp2 平面三角形 | ||
| C. | SO2 sp2 V形 | D. | NO3- sp3 三角锥形 |
15.下列微粒中,只有氧化性的是( )
①Cl- ②Fe2+ ③Fe3+ ④S ⑤H+ ⑥Na+ ⑦Mg.
①Cl- ②Fe2+ ③Fe3+ ④S ⑤H+ ⑥Na+ ⑦Mg.
| A. | ①⑦ | B. | ②④ | C. | ③⑤⑥ | D. | ②④⑤⑥ |
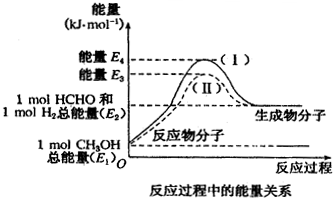
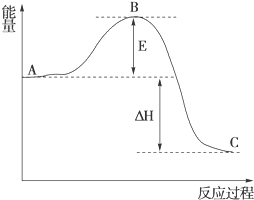 (1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,写出表示甲烷燃烧热的热化学方程式:CH4(g)+2O2(g)═CO2(g)+H2O(l)△H=-880kJ/mol.
(1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,写出表示甲烷燃烧热的热化学方程式:CH4(g)+2O2(g)═CO2(g)+H2O(l)△H=-880kJ/mol. 实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件,该小组同学为探究中毒原因进行了如下实验:
实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件,该小组同学为探究中毒原因进行了如下实验: