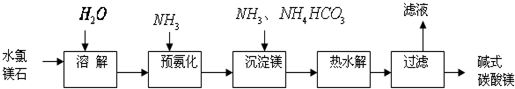
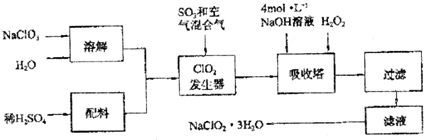
题目内容
12.某废水处理站用甲醇处理氨废水,反应为NH3+2O2$\frac{\underline{\;酶\;}}{\;}$NO${\;}_{3}^{-}$+H++H2O,6H++6NO${\;}_{3}^{-}$+5CH3OH$\frac{\underline{\;酶\;}}{\;}$3N2↑+5CO2↑+13H2O.在处理过程中,NH3转化为NO${\;}_{3}^{-}$,转化为NO${\;}_{3}^{-}$的转化率可达95%,而NO${\;}_{3}^{-}$转化为N2的转化率可达96%.若每天处理含NH3 0.034g•L-1的废水500m3,则理论上每天所需甲醇的质量为( )| A. | 24.32kg | B. | 30kg | C. | 25.3kg | D. | 4.08kg |
分析 由方程式可得关系式:6NH3~6NO3-~5CH3OH,将每一步转化率都转化为氨气的转化率,结合关系式计算.
解答 解:含NH3 0.034g•L-1的废水500m3中氨气为0.034g•L-1×500×1000L=17000g=17kg,
设需要甲醇质量为m,则:
6 NH3~6 NO3-~5 CH3OH
6×17 5×32
17kg×95%×96% m
所以m=$\frac{17kg×95%×96%×5×32}{6×17}$=24.32kg,
故选:A.
点评 本题考查化学方程式计算,涉及有损失率的多步计算,注意利用关系式进行解答,难度不大.

练习册系列答案
相关题目
20.pH=1.00和pH=3.00的两种强电解质溶液等体积混合溶液的pH为( )
| A. | 2.00 | B. | 1.30 | C. | 4.00 | D. | 5.00 |
7.用1L 1mol•L-1NaOH溶液吸收0.8molCO2,所得溶液中n(Na2CO3)和n(NaHCO3)之比约为( )
| A. | 1:3 | B. | 3:1 | C. | 2:3 | D. | 3:2 |